关于本书
近日,由清华大学药学院杨悦研究员主编,清华大学法学院王晨光教授作序,中国医药科技出版社出版的《非处方药监管科学》正式与读者见面。
该书是清华大学药学院药品监管科学研究团队的一项基于全球视野的非处方药监管的系统研究成果,也是非处方药研发创新与监管实践经验的总结。

Q1为什么出版非处方药监管科学?
非处方药的监管科学是一项具有专属性的议题和研究领域。
药品监管机构对于非处方药的安全性、有效性、质量的评估,必须基于其中的活性成分或者配方长期上市经验证据或者数据,已经确认有效性,而且具有安全性相对更高的特点,因此在药品注册管理中对非处方药适宜性、便利性、个性化监管要求给予充分的监管灵活性考虑,为非处方药的创新留下应有的空间。
本书的出版恰逢新修订的《药品注册管理办法》(2020年版)建立非处方药直接上市路径之际,也正当《处方药与非处方药分类管理办法》修订之时,希望本书的出版能够为监管机构、行业和企业提供一些非处方药研发和监管的新思维、新思路,为非处方药监管制度、路径和程序的优化提供有益的帮助!
Q2本书适合哪些读者阅读?
本书适合于从事非处方药研发和注册、监管,以及从事科研和教学的人员阅读。
由于非处方药注册与处方药有共同程序,本书中对药品注册分类和程序的内容也适用于处方药研发注册,但是同时结合了对非处方药的特殊要求。本书中区别于处方药注册的非处方药专属性内容是核心关键。阅读本书能够理解非处方药与处方药注册管理的共性,以及非处方药注册及管理的特殊性。
Q3书名为什么叫非处方药监管科学?
药品监管科学是有关评估药物全生命周期的安全性、有效性、质量和综合表现的新工具、新标准和新方法的科学。
本书是一项系统的、基于全球视角的非处方药监管科学研究专著,涵盖中、美、欧、加、澳、日六个国家或者地区的非处方药监管历程、注册管理、上市后监管等内容。特别包含非处方药评价的专属性的工具和方法的内容。
书中有关监管的新工具包括非处方药的专论或者标准,处方药与非处方药的分类和注册路径选择决策树工具等等。

书中有关监管的新方法是非处方药的人为因素评价方法,该方法是不同于处方药评价的独特方法。非处方药评价是在药品长期使用的安全性、有效性较为确定的基础上,研究药物作为非处方药使用的条件和说明书要求,特别注重对于说明书的理解力研究和个人使用研究等人为因素的评价,以确保在不依赖专业诊疗的情况下,患者仍可合理、安全使用非处方药。
Q4非处方药监管是国际监管议题吗?
是的,早在1970年,世界专有药品制造商协会联合会更名为世界自我药疗产业协会(WSMI),倡导将药品分为处方药和非处方药两类。1981 年,世界医学会在“患者权利宣言”中强调自我健康护理的责任。1998 年,WSMI 和国际药物联合会(FIP)强调药师在自我药疗中的作用。1998年,WHO将自我药疗定义为“个人选择和使用药物(包括草药和传统产品)治疗自我识别的疾病或症状。自我药疗是自我健康护理的一个要素”。1999年,FIP和WSMI将自我药疗定义为患者自行使用非处方药,并共同发布了倡导“负责任的自我药疗”(responsible self-medication)的联合声明。2000 年,WHO 发布了《用于自我药疗的药品监管评估指南》,向发展中国家建议实施处方药与非处方药分类管理模式。

图1 国际非处方药监管历程
非处方药监管是一个国际化的议题,也是WHO自我药疗健康倡议和监管指南的核心议题之一。无论是发达国家,还是发展中国家等都非常重视处方药与非处方药的分类管理工作,为非处方药建立了区别于处方药的独立监管路径、程序和要求。为了给自我药疗提供更多的非处方药选择,部分国家为非处方药建立单独的专论或者标识标准,基于这类产品风险较低的监管考虑简化注册要求,优化转化程序,促进处方药非处方药创新发展。对于非处方药的监管,除了必须具备安全性和有效性要求之外,更加注重满足不同人群的用药需求,在用药适宜性、便利性、个性化方面允许进行创新性的设计,更适合儿童、老年人以及有特殊需求的患者的自我诊断和自我用药选用。
Q5读者如何阅读?会有哪些获益?
《非处方药监管科学》一书可以作为非处方药研发和国际注册的工具书,也可以作为监管科学研究和政策制定的参考书。
可以有以下获益:
第一,可以同时了解6个国家的非处方药注册路径。由于除中国,日本以外的其他4个国家开辟了非处方药备案或者登记路径,相对于处方药的前置性上市审批,上市程序主要依赖企业的质量承诺。处方药与非处方药的上市后检查要求基本相同。非处方药上市更多地依赖市场竞争,建立品牌声誉。阅读本书可以为面向国际的非处方药研发上市拓宽视野。
第二,建立非处方药上市的路径思维。按照新药、改良新、仿制药、上市基础良好的药品(基于活性成分上市经验)等分类,不同国家建立了不同的注册路径。在创改仿的注册路径之外,还建立了标准路径或者专论注册路径,可以简化注册,但额外增加了人为因素影响评价等要求(理解力、个人使用研究等)。
第三,理解监管机构的监管考量,思考如何提高非处方药监管效率。在监管资源有限的情况下,建立以风险为基础的思维方式,在处方药上市和使用经验的基础上,遴选或者转化出某些有效性已经得到证实,安全性相对更好,无需医生处方或者辅助就可以自行购买使用的活性成分。对于非处方药的监管,除了必须满足安全性和有效性的基本要求之外,还注重满足不同人群的用药需求,在用药适宜性、便利性、个性化方面允许进行创新性的设计,更加适合儿童、老年人以及有特殊需求的患者的自我诊断和药疗。企业可以以专论或者标准中纳入的活性成分及其组合为基础开发新的非处方药上市。
第四,加深对非处方药研发创新的理解。非处方药绝大部分是老药,行业中有某些偏见,认为非处方药没有创新。事实上,非处方药的创新偏重于自我药疗适宜性、方便性和满足个性化需求的创新。
Q6书中有数据和案例吗?
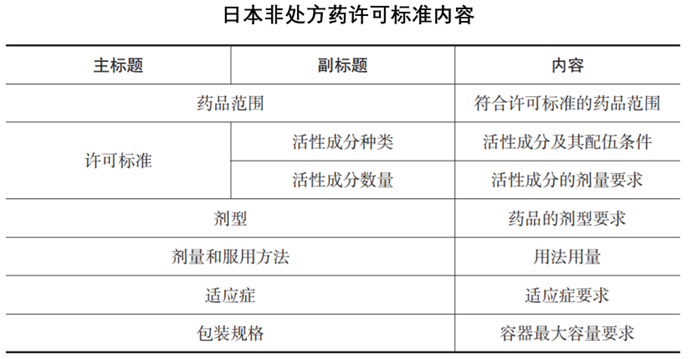
书中包含了中国等6个国家的非处方药专论或者标准的内容分析,并对专论或者标准中的API数量进行了统计。
为了直观地说明非处方药的创新性。本书第十章中给出了17个非处方药创新的案例,说明如何进行适合消费者自我药疗的非处方药创新,使读者理解,非处方药研发创新也是具有临床价值的。
Q7阅读本书能够发现各国的非处方药监管差异吗?
本书第八章对各国非处方药监管的涵义、组织架构、直接上市路径、处方药转换非处方药路径、相关独占权、上市后不良反应监测、生产许可与检查、经营监管、广告管理以及标识管理这十个方面进行了比较,并深入分析了存在差异的原因。本书并非简单的法规罗列,是对各国非处方药监管科学现象和规律的深入研究。

