2024年4月12日,清华大学基础完美体育·(中国)官方网站胡小玉课题组在《Immunity》杂志在线发表了题为“Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity”的研究论文。该文章以定植于肠道上皮中的一类特殊肥大细胞群体为研究对象,揭示了这群肥大细胞在二型免疫反应中所起的重要作用,并阐述了这群肥大细胞与上皮细胞相互作用,激活上皮细胞中的Gasdermin C蛋白,从而介导二型免疫关键细胞因子IL-33分泌的多细胞互作链条。
相较于多群备受关注的免疫细胞,肥大细胞在近年来的免疫学研究中似乎遭到了相对的忽视。而关于肥大细胞的功能研究也常常拘泥于已知范式中,比如免疫学教科书与各种综述论文通常将肥大细胞功能等同于IgE介导的脱颗粒行为。然而在进化历程中肥大细胞的出现早于最原始的获得性免疫系统2亿余年,这一事实提示肥大细胞必然具备与IgE无关的功能,而这些功能很可能是肥大细胞存在的基本特性。
其实早在1919年,一位德国病理学家已经在包括猫、狗和绵羊等物种的肠道上皮中观察到了嵌于上皮细胞之间肥大细胞。然而,这群定植于上皮中的肥大细胞功能一直未知。课题组在研究二型免疫反应过程中,使用寄生虫感染模型,也观察到了这群上皮间肥大细胞(intraepithelial mast cell,IEMC)(图一A)。他们使用b7整合素等分子标记物,成功从肠道中分离出了IEMC,检测了IEMC基因转录组和表观遗传组等特性,提示此类细胞很可能积极参与细胞间互作。这一分子图谱分析结果也与IEMC体内定位相吻合,于是研究下一步聚焦于IEMC与上皮细胞互作。他们进一步发现IEMC可以通过生成纳米微管等方式,将IEMC中特有的蛋白酶Mcpt1等物质传递给上皮细胞,从而实现IEMC与上皮细胞之间的直接相互作用。值得一提的是,此类互作不依赖于IgE, 可以在体外由仅有IEMC和上皮细胞的共培养体系完全重构(图一B)。
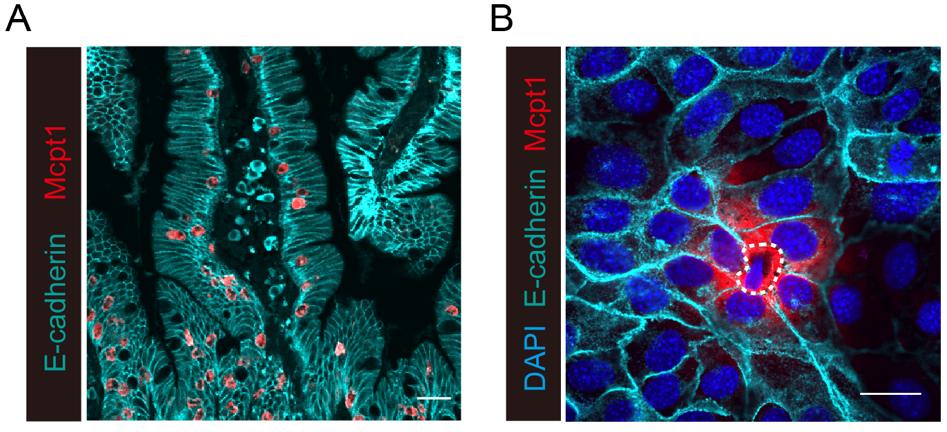
图一 IEMC紧密排列在肠道上皮中,并与上皮细胞相互作用。
随后的关键问题是IEMC输送到上皮细胞中的物质发挥了怎样的生物学功能。经过费劲摸索,他们发现IEMC可以介导肠道上皮细胞内Gasdermin C(Gsdmc)蛋白的切割激活;在肥大细胞缺失的小鼠中,上皮细胞中的Gsdmc则完全无法被切割(图二)。在具体分子机制的研究中,他们纯化了IEMC中特异性高表达的酶,与Gsdmc蛋白共孵育后发现,Mcpt1可以切割Gsdmc。他们同时使用了Mcpt1敲除小鼠模型,同样也发现Mcpt1缺失部分抑制了Gsdmc的切割。在免疫学功能方面,IEMC介导的Gsdmc激活促使上皮细胞内二型免疫关键细胞因子IL-33释放到胞外,促进ILC2激活,最终加强肠道内的二型免疫反应。这些结果发现了至少一个在体内具有切割Gsdmc活性的蛋白酶,阐述了一种Gsdmc在生理过程中的激活机制。
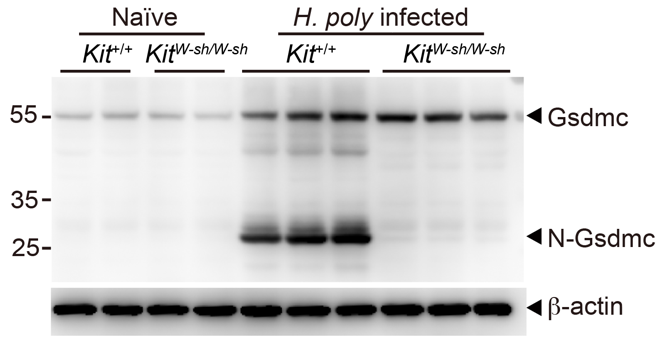
图二 肥大细胞缺失(Kitw-sh/w-sh)小鼠肠道上皮细胞内的Gsdmc无法被切割。
综上所述,这些免疫机制与生化手段相结合的研究揭示了肥大细胞的全新作用方式,即IEMC与上皮细胞相互作用构成肠道二型免疫反应中不可或缺的一步(图三)。此项工作为肥大细胞及其相关的二型免疫反应机制研究打开了新思路。目前发表的研究仅仅是序幕,已经进化了6亿余年的肥大细胞留给我们太多的未知,利用现代state-of-the-art技术手段重新认知与定义这群古老的细胞势在必行,也许在不远的将来会带给我们更多惊喜。
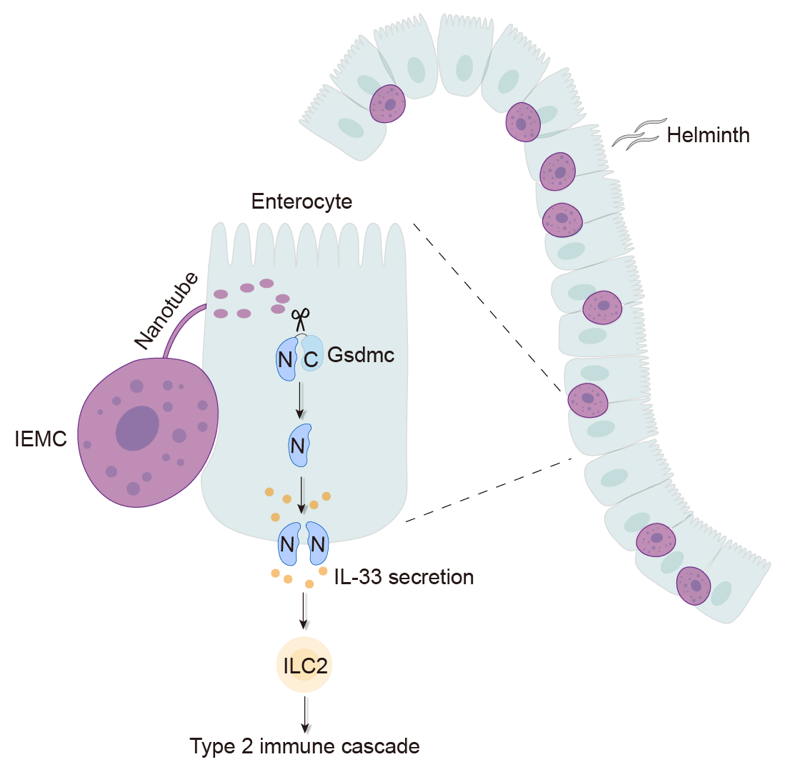
图三IEMC介导肠道上皮细胞中的Gsdmc切割,并激活下游二型免疫反应。
本研究由基础完美体育·(中国)官方网站胡小玉课题组与北京生命科学研究所邵峰课题组紧密合作完成。胡小玉教授为本文的通讯作者。胡小玉课题组博士后杨柳与邵峰课题组博士后何华斌为本文共同第一作者,杨柳博士与何华斌博士为清华大学毕业的同窗,在博士后期间再度携手攻关。该论文得到了来自清华大学生命科学学院/免疫学研究所的刘万里教授大力支持。该研究得到了科技部、国家自然科学基金委、清华大学-北京大学生命科学联合中心、清华大学免疫学研究所和广州实验室的资助。
胡小玉实验室的主要研究领域为髓系细胞在组织微环境中的功能,聚焦巨噬细胞和肥大细胞两类组织驻留髓系亚群。以上介绍的肥大细胞研究延伸出关于起源、功能、治疗等多个独特的研究方向,现课题组招聘多名博士后与助理/副研究员,欢迎感兴趣的小伙伴加入团队一起拓展髓系细胞功能研究的边界。有意向者请将个人简历发送至邮箱:hulab_d311@163.com,邮件标题注明:应聘+具体岗位。
专家点评
Lai Guan Ng 教授 上海交通大学完美体育·(中国)官方网站附属仁济医院-上海市免疫治疗创新研究院
Lai Guan Ng教授于2004年在澳大利亚悉尼的Garvan医学研究所获得博士学位后,他加入了新加坡分子与细胞生物学研究所,在林光平教授的指导下进行博士后培训。2006年,Ng博士加入了美国费城威斯塔研究所 Wolfgang Weninger 教授的实验室。在完成博士后培训后,Ng博士于2009年加入新加坡免疫学研究所(SIgN)成为独立研究员。他于2023年开始担任上海免疫治疗研究所高级研究员、系统免疫学中心主任和上海交通大学教授。他的团队的主要研究重点是研究免疫细胞在整个器官背景下如何发挥其功能。Ng博士在免疫学研究领域的贡献在许多重要期刊上发表了多篇文章,如Science、Immunity、Nature Immunology和Journal of Experimental Medicine等。
肥大细胞在机体对抗蠕虫等寄生虫感染和接触过敏原刺激所引起的2型免疫反应中发挥着关键作用。肥大细胞被激活后发生脱颗粒,分泌其胞内储存的多种生物活性介质以此发挥生理功能。根据其在机体内定位分布和功能特征的不同,肥大细胞可分为结缔组织肥大细胞(CTMCs)和黏膜肥大细胞(MMCs)。CTMCs存在于皮肤和腹膜等组织中,对伤口愈合和病原体防御至关重要。MMCs位于呼吸道和胃肠道黏膜,在黏膜免疫反应中扮演重要角色。早在20世纪初,已有研究报道了一种独特的上皮内肥大细胞亚群,然而其发挥的功能作用仍未可知。这类亚群的存在突破了传统意义上肥大细胞的二分类法,更进一步强调了肥大细胞是机体免疫反应复杂调控网络中的重要一环。
来自清华大学基础完美体育·(中国)官方网站胡小玉教授课题组揭示了肠道中的肥大细胞可被归类成 Mcpt1所标记的肠上皮肥大细胞(IEMCs)和另一群位于固有层的Mcpt4标记的肥大细胞 (LPMCs)。随后,作者进一步证明了IEMCs能够定位于上皮层是由α-E整合素介导,并提供了关键证据表明IEMCs在上皮细胞内Gsdmc切割的过程中发挥关键作用。众所周知,gasdermin家族成员能够介导胞膜穿孔并诱发细胞焦亡。而本研究的作者们出乎意料地发现IEMCs虽然促进上皮细胞中的Gsdmc激活,然而该活化并未造成上皮细胞的坏死性死亡、凋亡或焦亡。更为重要的是,IEMCs引起的上皮细胞内Gsdmc活化促使上皮细胞释放IL-33,而IL-33对于介导2型免疫反应和促进肠蠕动十分关键。研究的最后,作者们证明了在机体2型免疫反应中,源自IEMCs的酶,其中包括Mcpt1都参与了上皮细胞Gsdmc的切割。
本研究在肠道微解剖环境中揭示了肥大细胞的异质性,成功鉴定出两个独特亚群,即肠上皮肥大细胞(IEMCs)与固有层肥大细胞(LPMCs)。此次亚群的成功鉴定为肥大细胞多样性的探索奠定了新的理论框架,并显著提升了领域内对肥大细胞在肠道免疫反应中扮演重要角色的认知。此外,本研究强调了在机体稳态及病理条件下深入探讨肥大细胞在不同组织中的定位分布及其免疫功能之间本体关系的重要性。更为重要的是,该研究对肠道内肥大细胞异质性的阐释或能为靶向肥大细胞从而治疗肠道炎症和过敏反应开辟新思路。
吴船 研究员 美国国立卫生研究院国家癌症研究所
吴船博士在上海交通大学完美体育·(中国)官方网站获得了医学博士学位,他随后在德国明斯特大学进行了自然科学博士研究培训,专注于自身免疫过程中T细胞的迁移研究。他在2010年赴哈佛完美体育·(中国)官方网站布里格姆和妇女医院进行了博士后培训,主要研究T细胞分化的转录调控。2016年,吴博士加入了哈佛完美体育·(中国)官方网站布里格姆和妇女医院,担任助理教授,之后于2017年转至美国国立卫生研究院国家癌症研究所担任Earl Stadtman研究员,此期间他的研究重点专注于黏膜屏障功能维持的免疫调控。吴船博士多次以通讯作者身份在Cell、Immunity、Blood等国际一流期刊中发表了研究成果。
肥大细胞作为一种重要的免疫细胞,广泛分布于结缔组织、粘膜和皮肤等组织中。它们被研究的主要功能包括防御感染,调节过敏反应,以及促进肿瘤生长和侵袭。近年来,免疫学和细胞生物学研究揭示了肥大细胞的多种新功能,如调节肠道菌群、调节骨骼代谢等。在免疫反应方面,肥大细胞可以分泌多种细胞因子,调节T细胞等免疫细胞的活性,参与免疫调节。尤其是其在2型免疫反应中的重要角色使肥大细胞在黏膜免疫中起到关键作用,参与了包括抗寄生虫宿主防御和过敏反应的发生发展。虽然肥大细胞本身的功能机制相对清晰,但其如何在特异组织微环境中通过细胞间相互作用调控2型反应的机制仍不清楚。
基础完美体育·(中国)官方网站胡小玉教授实验室结合不同的感染以及炎症模型,长期致力于研究天然免疫的细胞和分子生物学机制。此次研究中,胡小玉团队利用蠕虫感染模型,发现上皮内肥大细胞(IEMC)会与相邻的肠道上皮细胞通过细胞-细胞相互作用诱导2 型免疫反应,继而促进宿主对寄生虫的清除。在蠕虫感染过程中,IEMC可以通过细胞微管,将其特异性的蛋白酶Mcpt1转运至相邻的上皮细胞中。Mcpt1可继而酶解肠上皮细胞中的Gasdermin C 蛋白,使其发生裂解活化,从而导致肠上皮细胞中的2 型细胞因子白介素33(IL-33)的释放。IL-33在肠道组织中的增加可促进Th2细胞以及2型固有淋巴细胞(ILC2)的反应,促进2型细胞因子的释放,帮助宿主清楚体内的寄生虫。重要的是,研究团队还利用不同的遗传性工具证明了体内肥大细胞或者Mcpt1的缺失可消除由上皮细胞启动的Gasdermin C 介导的免疫级联反应。这些发现揭示了 IEMC 的重要功能,揭示了通过肥大细胞-肠上皮细胞互相作用下的 2 型免疫反应,并进一步增加了我们对 Gasdermin C 激活的细胞机制的认识。
胡小玉团队的这一发现促使我们重新评估肥大细胞在2型反应中的作用,并进一步研究IEMC的分子特征和功能意义。这些研究结果强调了肥大细胞和上皮细胞之间的相互作用是粘膜免疫的一个重要方面,并为未来在各种生理和病理条件下研究肥大细胞提供了研究工具和方向。同时,这也为我们研究组织特异性肥大细胞打开了新的视角。
