近日,清华大学药学院王钊课题组在《食品科学与人类健康》(Food Science and Human Wellness)在线发表了题为《高淀粉饮食通过增加NOX2介导的脂肪酸转运入肝加剧NAFLD》(A high-starch carbohydrate diet exacerbates NAFLD by increasing NOX2-mediated fatty acid influx)的研究论文,该研究首次系统论证了高淀粉饮食对非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的影响,并探究发现了高淀粉饮食通过介导NOX2高表达,以增加脂肪酸转运的独特代谢方式介导了NAFLD的恶化。
一、研究背景
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是以肝内脂质大量堆积为特点的肝脏脂代谢异常类疾病,当前全球患病率超过25%,在中国的部分地区更是高达30%。极大威胁人们的生命健康,对社会经济造成严重负担
以往研究中,饮食中脂质以及简单糖的大量摄入被认为是导致NAFLD发生发展的“元凶”,这使得很多脂肪肝患者通过增加对米、面等淀粉类碳水化合物的摄入来替代、减少脂质以及游离糖摄入,从而期待达到缓解、治疗NAFLD的效果。然而,这种高淀粉的饮食模式对NAFLD有何影响,其调控机制与游离糖有何区别,目前尚未有明确报道。本研究聚焦于高淀粉饮食模式,系统性的阐明了高淀粉饮食对NAFLD的影响及调控机制,为进一步理解淀粉这一重要营养物质的代谢特点、探寻靶向高淀粉饮食所介导的NAFLD的治疗方法提供了新的思路。
二、研究成果
1、高淀粉饮食介导NAFLD的发生和发展
在本研究中,通过自主设计无脂质、无游离糖的高淀粉饮食(high-starch carbohydrate diet, HCD),以每天定时、等热量的方式连续干预NAFLD小鼠16周,发现高淀粉饮食非但不会缓解、反而会进一步增加肝内脂质含量并提升肝内炎症,且其恶化程度更甚于一直维持高脂饮食的小鼠(图一)。同时,在健康小鼠中,长时间的高淀粉饮食同样会介导NAFLD的发生,并且是以先诱发炎症,后表现出脂质堆积的顺序进行。此外,利用阿卡波糖限制小鼠肠道中淀粉的吸收可以显著改善HCD介导的NAFLD恶化,反向证明了高淀粉饮食对于NAFLD的负向调控作用。以上发现在细胞水平也得到了一致的验证结果。从而本研究从多角度、系统性的阐明了高淀粉饮食诱导NAFLD发生、并介导NAFLD的进一步恶化。
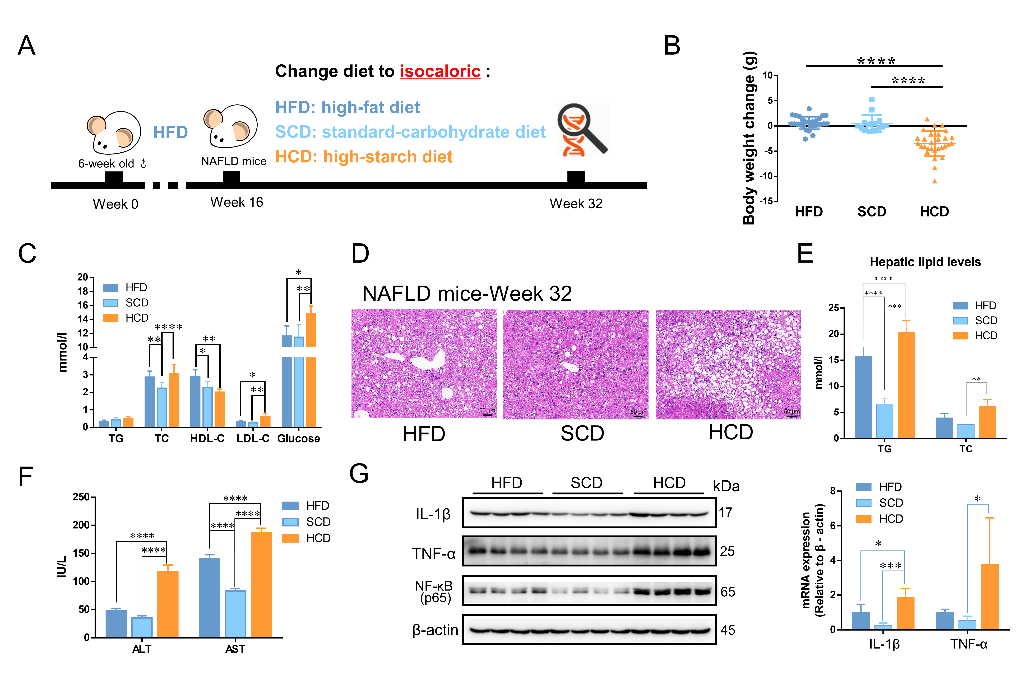
图一 高淀粉饮食加重NAFLD小鼠肝内脂质堆积并提升肝内炎症水平
2、脂肪酸内流增加是高淀粉饮食介导NAFLD恶化的独特代谢途径
NAFLD的最主要特征是肝脏内甘油三酯的大量堆积。肝内的甘油三酯含量由5条代谢途径共同决定,其中包括 3条“经典”脂质代谢途径:“糖酵解-脂质从头合成”途径、“ChREBP-脂质从头合成”途径、“脂肪酸β氧化”途径;2条“非经典”脂质转运途径:脂肪酸转运入肝途径、VLDL-TG复合体转运途径。通过对以上5条代谢途径中关键酶进行测定,我们发现高淀粉饮食仅在脂肪酸转运途径中表现相较于高脂饮食组小鼠的表达量提升。同时,结合肝脏代谢组学分析数据,进一步证实了以上发现(图二)。从而表明在高淀粉饮食干预下,脂肪酸内流的增加是导致肝内甘油三酯进一步沉积的主要原因。
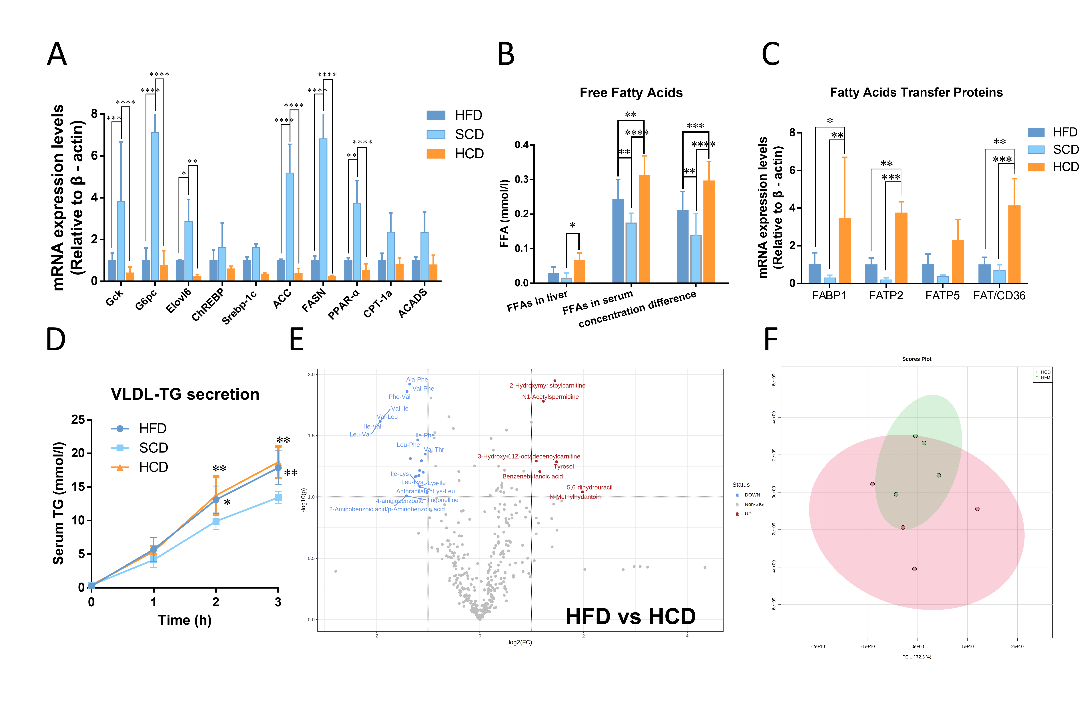
图二 高淀粉饮食通过增加脂肪酸转运入肝介导NAFLD恶化
3、高淀粉饮食提升肝内NOX2表达、促进NOX2组装及功能发挥
为明确高淀粉饮食加重NAFLD的分子调控机制,我们对饲喂高脂饮食以及高淀粉饮食的小鼠进行了肝脏转录组学的测定,通过联合运用KEGG、GO、GSEA分析,并依据前期实验表型,聚焦与炎症、代谢相关,且基因表达差异以及基因变化数量显著的通路,发现在吞噬体通路中,高淀粉饮食组小鼠表现出相较于高脂饮食组小鼠的显著激活,并且,吞噬体通路中NADPH氧化酶各个亚基含量显著提升。随后,我们在细胞以及动物水平均证明了NADPH氧化酶亚型NOX2以及NOX2亚基在高淀粉饮食条件下,表达量显著升高,并表现出NOX2激活的关键特征,即胞内亚基向胞膜转移的现象(图三)。同时,肝内的NOX2高表达同步表现为肝内活性氧水平的显著提升。从而证明高淀粉饮食介导肝内NOX2高表达、促进NOX2组装及功能发挥。
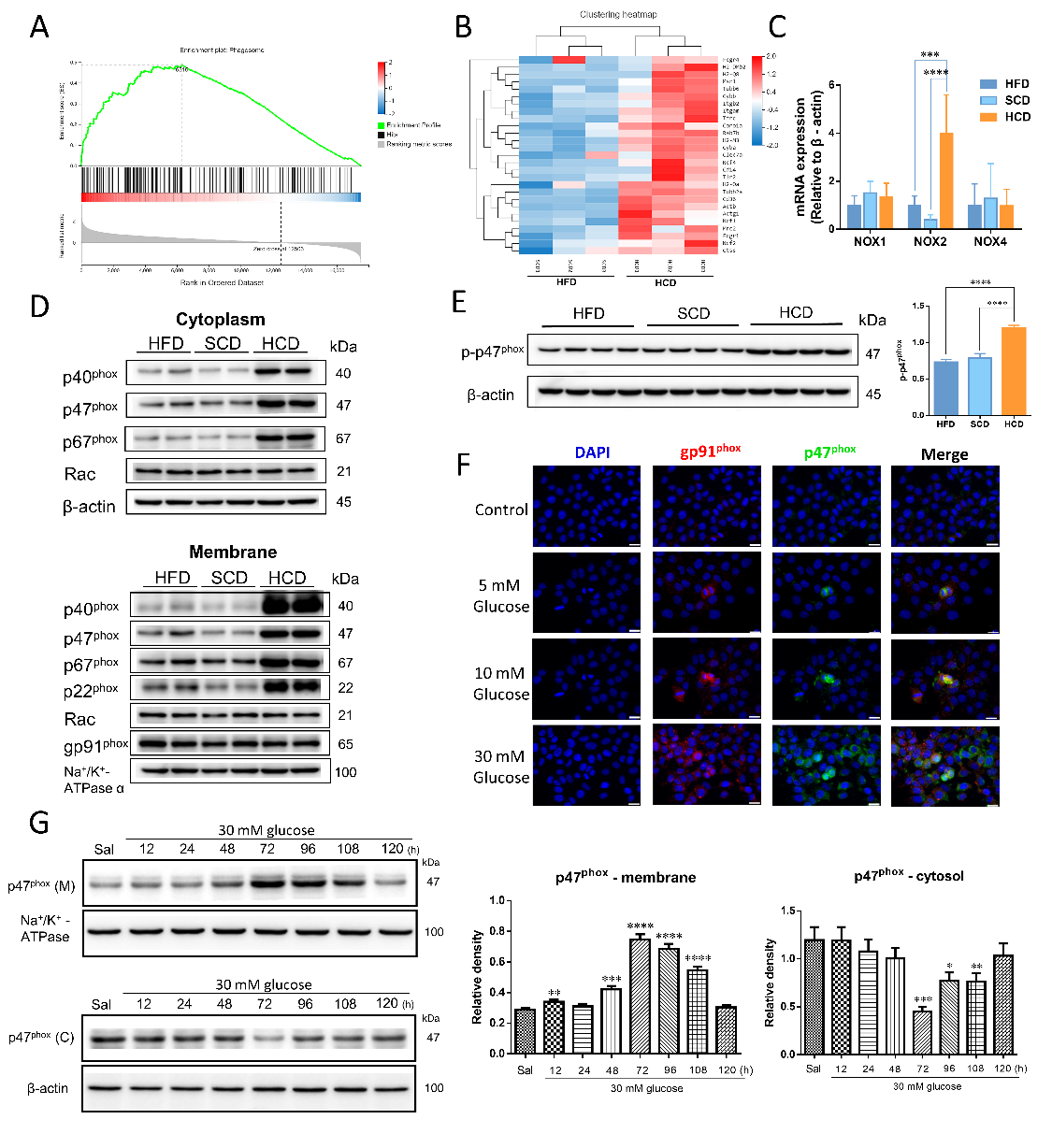
图三 高淀粉饮食提升肝内NOX2表达并促进NOX2组装
4、NOX2是高淀粉饮食介导NAFLD的特异性调控因子
为进一步证明高表达的NOX2是高淀粉饮食介导NAFLD恶化的主要原因,我们在NAFLD小鼠中通过腺相关病毒构建了肝脏特异性敲低p47phox(介导NOX2组装的关键亚基)的小鼠,并同步将小鼠饮食更换为与高脂饮食等热量的高淀粉饮食。研究发现,敲低p47phox可以抵抗高淀粉饮食所致的肝内脂质堆积、炎症因子浸润以及纤维化加重,但是在继续维持高脂饮食的小鼠中,敲低p47phox并不会表现出相应的缓解作用。同时,在高淀粉饮食条件下,敲低p47phox的小鼠表现出肝脏脂肪酸转运的抑制和肝内活性氧水平的降低(图四)。此外,通过分析细胞活性氧来源以及能量感知分子AMPK的活性表达,进一步提出NOX2介导的活性氧是NOX2调控脂肪酸转运的关键分子,并且论证得到AMPKα1/p47phox是高淀粉饮食介导NOX2高表达的依赖途径。
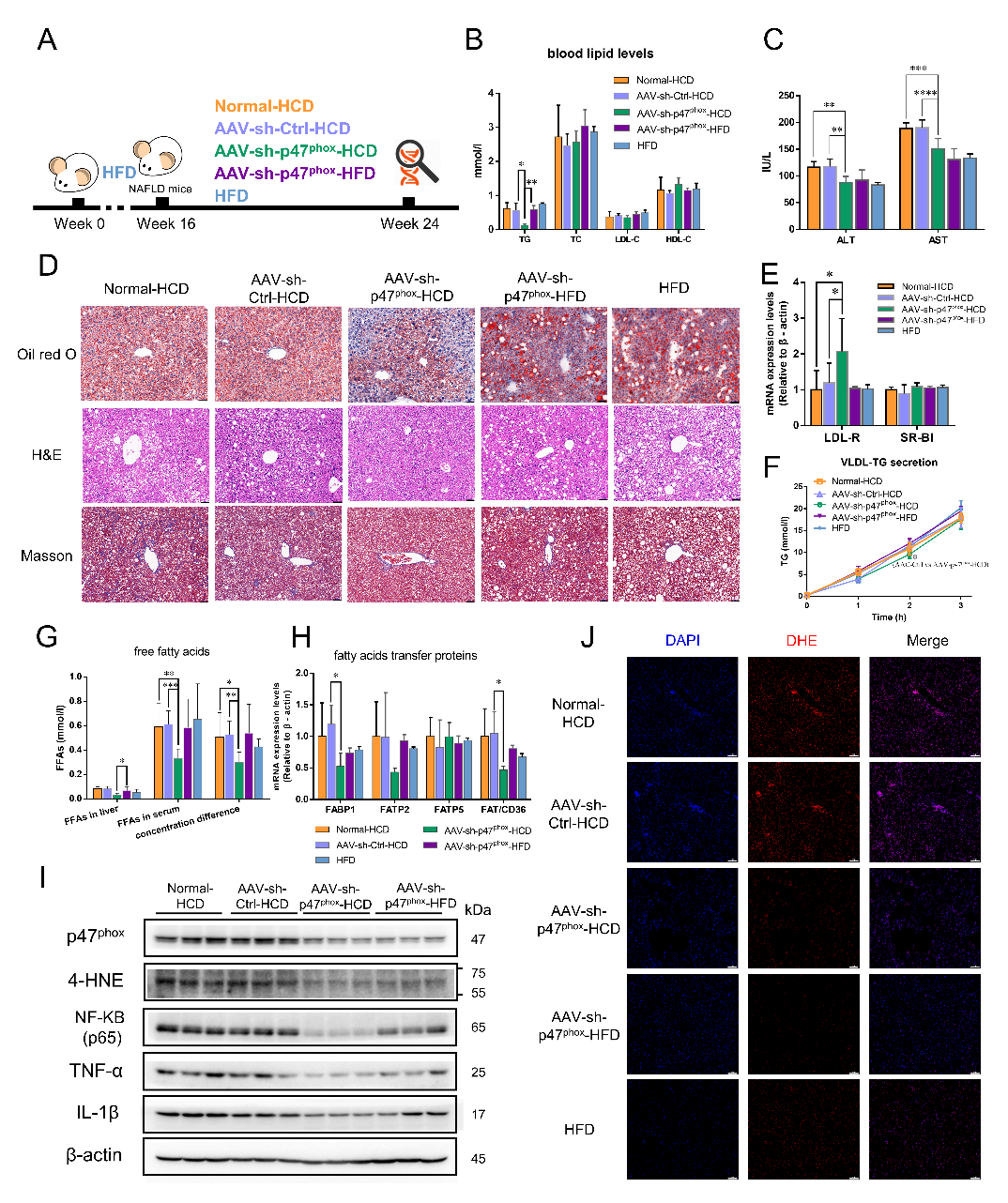
图四 NOX2是高淀粉饮食介导NAFLD恶化的特异性调控因子
三、总结
综上所述,本研究首次在小鼠水平系统性地探究并得到,长期高淀粉饮食会介导NAFLD发生,并进一步促进NAFLD的恶化。机制上,阐明NOX2作为该过程的特异性调控因子,通过增加脂肪酸转运介导NAFLD的进一步恶化,揭示淀粉类碳水化合物不同于游离糖的独特代谢特点。本研究系统性的阐释了淀粉这一重要营养物质对机体生理病理的影响及其代谢机制,为精准营养措施改善NAFLD提供了新的思路,同时为NAFLD患者提供了科学的膳食营养指导和参考。
清华大学药学院王钊教授为本文通讯作者,药学院王钊课题组2017级博士生高钰琪为该论文第一作者,课题组成员花瑞、彭柯峥、尹月淼、曾晨叶、郭彦南、王译达、李丽媛、完美体育·(中国)官方网站李雪高级工程师,完美体育·(中国)官方网站裘莹副教授为本研究提出了宝贵意见及指导。本项目受国家自然科学基金(82170873; 81871095),国家科技部重点研发计划(2018YFC2000304),清华大学春风基金(20211080005)的支持与资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2213453022002452
