2021年 2月 8日,清华大学药学院肖百龙课题组在《自然•通讯》(Nature Communications) 杂志在线发表了题为《机械门控离子通道Piezo1介导心脏的机械-化学传导》(The mechanosensitive Piezo1 channel mediates heart mechano-chemo transduction)的研究长文,揭示了机械门控Piezo1离子通道是作为心肌细胞的机械传感器,可以直接感受机械力并将其转化为 细胞内钙信号和 活性氧物质(reactive oxygen species, ROS)信号,从而维持心脏功能稳态,其表达异常参与心脏疾病的发生。该研究为一百多年前所发现的著名的心脏生理学现象 “Frank-Starling 规律”和“Anrep 效应”提供了分子机制方面的解释,也提示Piezo1可以作为治疗心脏疾病的重要新型药物靶点。
心脏跳动过程中经历着剧烈的机械力变化,并可以进行自我调节改变心输出量以适应心脏周期中的血液动力学变化。舒张末期容积增加引起心室壁扩张,心肌纤维会被拉长,心室壁受压,使得心肌的收缩力上升,心输出量增加,随后力缓慢持续增加数分钟。这种心脏适应前、后负荷使心输出量增加的机制被分别命名为Frank-Starling规律和Anrep效应。尽管Frank-Starling现象的部分解释是由于肌源纤维的钙敏感性增加引起的,同时有证据表明心肌细胞钙浓度的增加在调节拉伸诱导的心脏收缩增强过程中起关键作用。科学家们推测机械门控阳离子通道赋予心肌细胞机械敏感性并且介导心脏的机械传导,通过钙信号传递,决定心脏收缩的强度。然而直至100多年后的今天,尚未确定这种潜在的机械传导通道以及其在正常和患病心脏中的作用。
机械门控Piezo离子通道是哺乳动物中发现确立的首类机械门控阳离子通道家族,包含Piezo1和Piezo2两个成员 (Coste et al., Science 2010; Coste, Xiao et al., Nature 2012)。Piezo1在包括内皮细胞、红细胞、平滑肌细胞、上皮细胞以及成骨细胞等多种细胞类型中介导机械敏感阳离子电流,并触发下游钙信号通路以完成广泛的细胞学功能。Piezo1在血管系统中承担非常重要的作用,参与调控包括血管及淋巴管发育、血管收缩、红细胞体积以及阻力动脉重塑等诸多生理过程。此外,Piezo1与Piezo2一起被认为作为压力感受器神经元(baroreceptor)中的机械传感器感受血压,通过反射性控制心率和心输出量从而维持血压稳态。然而,Piezo1在心肌细胞和心脏中的表达和功能尚未被报道。
积累:聚焦机械门控Piezo通道研究
肖百龙博士课题组利用生化结构、电生理、高通量药物筛选、转基因小鼠模型以及人类遗传学等多学科研究手段,聚焦解答机械门控Piezo通道如何将机械力刺激转化为电化学信号,以及其如何利用自身机械敏感性和通道特性来决定相关的生理病理功能,并致力于开发以Piezo通道为靶点的新型药物及技术。迄今在Piezo通道的三维结构解析 (Nature 2015, 2018, 2019)、分子机制揭示 (Neuron 2016; Nature Communications 2017; Neuron 2020;BioRxiv 2020)、小分子药物发现 (Nature Communications 2018)、以及生理病理功能探索 (Cell Reports 2019; eLife 2019) 等方面取得了系列重要研究成果。肖百龙博士获邀为2020年度Annual Review of Pharmacology and Toxicology (2020 Jan 6; 60:195-218) 撰写了年度综述文章,系统介绍了Piezo通道在近10年的重要研究进展以及其作为新型药物靶点进行药物开发的重要前景和策略。
探索:发现Piezo1通道在心脏中的重要作用
在最新发表的这篇《自然•通讯》研究论文中,研究人员利用多种转基因小鼠模型、结合单个心肌细胞的机械张力操控、以及钙和ROS信号的测量检测手段,发现Piezo1通道在心肌细胞膜上呈点状和横纹样表达,并作为心肌细胞的机械传感器介导心脏的机械化学传导,直接将机械力转化为钙和ROS信号通路,为解释机械力和心脏做功之间的正相关提供了分子基础。Piezo1在心脏中维持心脏功能稳态平衡,并且在病理条件下影响心脏疾病的发展。
1.维持心脏功能稳态平衡
他们发现心肌细胞中的Piezo1可以介导机械力诱导下的钙响应以及细胞中钙稳态平衡。当心肌细胞受到机械力刺激激活Piezo1,依赖Piezo1的Ca2+内流通过Rac1-NOX2信号通路调节ROS的产生和稳态,进而作用于RyR2(钙离子释放通道)来改变其通道活性 (图1)。表明在这两个对心脏功能至关重要的信号分子之间存在Piezo1介导的一个正反馈回路,从而使表达在心肌细胞中的Piezo1能很好的响应由心脏跳动产生的剧烈和周期性的机械压力。
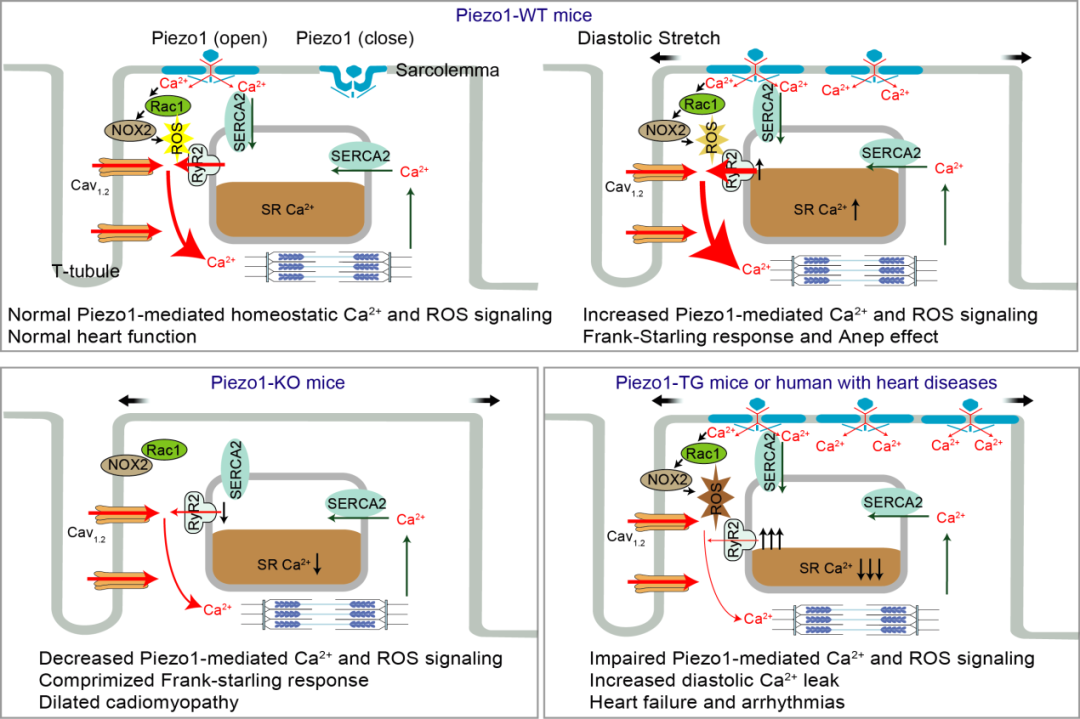
图:机械门控Piezo1通道介导心肌细胞机械-化学信号转导、维持心脏功能稳态并参与心脏疾病发生。
心肌细胞特异性敲除或过表达Piezo1导致钙信号和 ROS信号失调以及心脏功能障碍,证明了Piezo1可以维持心脏功能稳态。当心肌细胞受到机械力刺激,Piezo1开放引起的钙内流一方面增加肌浆网钙库的含量,并通过NOX2-ROS信号通路增强RyR2的通道活性,可导致心肌细胞在收缩期的钙反应增强从而增加心肌细胞的收缩强度,从而维持心脏正常功能稳态。敲除Piezo1导致钙内流和ROS产生的减少,从而导致肌浆网钙含量降低以及RyR2通道的敏感性降低,阻断了正反馈回路,引起心脏泵血功能下降,导致扩张型心肌病;而过表达Piezo1则引起钙内流和ROS过度产生,引起自发性肌浆网钙泄漏增加,致使肌浆网钙库大量损失,并产生可致心律失常的钙波,最终导致Piezo1过表达小鼠出现严重的心力衰竭和心律失常表型。
2.提供心脏病治疗新靶点
在一些组织和细胞中Piezo1通道和机械力之间存在正反馈关系,例如神经胶质瘤和成骨细胞。在心脏中也存在这种正反馈关系,Piezo1在小鼠疾病模型和人类患病心脏中均自主上调,研究者认为在心脏机械负荷(病理或衰老)刺激下Piezo1首先适应性上调,但由于钙和ROS信号的正反馈机制,最终导致心肌病的产生。他们发现Piezo1缺失可以逆转药物诱导的心肌细胞损伤。因此,阻断Piezo1有可能作为治疗人类心脏疾病的新的治疗策略。
肖百龙研究员为本文通讯作者,肖百龙研究组2014级生命学院CLS项目博士研究生姜凡为本第一作者,已毕业博士生吴坤和张明敏参与了部分工作。阜外医院周洲教授及其博士殷昆仑提供了心脏疾病病人样品,北京大学的程和平教授和王世强教授对该课题提供了鼎力支持。本研究得到了国家重点研发计划(2016YFA0500402, 2015CB910102)、国家自然科学基金重点项目(31630090)和杰出青年科学基金(31825014)、清华-北大生命科学联合中心、北京市高精尖结构生物学中心、膜生物学国家重点实验室的资助。
