2019年8月21日,《自然》 (Nature) 期刊以长文形式在线发表了由清华大学药学院肖百龙课题组与生命科学学院李雪明课题组合作撰写的《哺乳动物触觉感知离子通道Piezo2的结构与机械门控机制》(Structure and Mechanogating of the Mammalian Tactile Channel Piezo2)研究论文,首次报导了赋予我们人类自身触觉感知能力的机械力分子受体-Piezo2离子通道的高分辨率的冷冻电镜三维结构和精巧工作机制。该研究也是两个课题组继2018年1月22日合作在《自然》报导机械门控Piezo通道家族另一成员-Piezo1离子通道的高分辨率三维结构和分子机制后,在该研究领域的又一重要研究成果,不仅有力推动了对Piezo通道家族的结构基础和分子机制的理解,也为基于Piezo通道的药物开发奠定了坚实的基础。《自然》同时刊发了评论员文章对该研究作了高度评价。

触觉作为五感之一,不仅赋予我们感知握手、轻抚、亲吻等愉悦性触碰以维持正常社交行为的能力,而且承担着人类能够熟练使用各种工具譬如触摸屏手机或鼠标的生物学基础。而在组织损伤或炎症等病理情况下,触觉感知功能的异常可以导致严重的机械超敏痛(又称触摸痛)。譬如,癌症或关节炎病患者会经常遭遇类似穿衣服或行走等轻微触碰所带来的剧烈疼痛,严重影响个体健康与生活质量。另外,自闭症患者通常显示较常人更为敏感的触觉感知能力,最近的研究提示这一触觉功能的异常可能是导致自闭症的重要病因之一。
触觉感知源于表达在初级感觉神经元上的机械力感知分子受体-机械门控阳离子通道对机械力刺激的响应,从而引起细胞外的阳离子例如钠离子和钙离子流入细胞,进而诱发神经细胞兴奋和信号传递,最终导致触觉的产生。2010年,美国斯克利普斯研究所的Ardem Patapoutian教授课题组鉴定发现Piezo基因家族编码哺乳动物机械门控阳离子通道的必要成分 (Coste et al., Science 2010)。2012年,在Patapoutian教授课题组从事博士后研究的肖百龙博士与其同事合作在《自然》期刊报道Piezo蛋白构成机械门控阳离子通道的核心孔道组成成分,从而首次确立了机械门控Piezo通道这一全新离子通道家族类型。
随后的研究证明Piezo2介导哺乳动物的触觉、本体觉(譬如体位平衡感知)以及内脏觉(譬如肺的收缩扩张以及血压感知和心率调节)的机械感知,而Piezo1则被发现在多种细胞组织中承担机械力分子受体的功能参与调控血管及淋巴管发育、血压稳态、骨的生成与重塑等诸多功能。Piezo基因的遗传突变被发现引起多种人类遗传疾病,包括红细胞干瘪综合症、淋巴管水肿、远端关节挛缩症、触觉缺失症等。携带Piezo2功能缺失型突变的人体不仅表现出触觉以及本体感觉缺陷,且丧失病理状态下的机械超敏痛感知,确证Piezo2通道可以作为开发新型镇痛药物的重要靶点。
肖百龙博士课题组综合利用生化结构、电生理膜片钳、高通量药物筛选、转基因小鼠模型以及人类遗传学等多学科研究手段,聚焦解答机械门控Piezo通道如何将机械力刺激转化为电化学信号,以及其如何利用自身机械敏感性和通道特性来决定相关的生理病理功能这两方面的关键科学问题,并致力于开发以Piezo通道为靶点的新型药物及技术。迄今以通讯作者(含共同)身份在Piezo通道的三维结构解析(Nature 2015, 2018,2019)、分子机制揭示 (Neuron 2016;Nature Communications 2017)、小分子药物发现(Nature Communications 2018)、以及生理病理功能探索(Cell Reports 2019;eLife 2019)等方面取得了系列重要研究成果。
在最新的这篇《自然》论文中,依托两个课题组之前对Piezo1通道进行冷冻电镜结构解析所建立的技术体系和研究平台,研究人员经过 6年多的不懈努力,克服全长2822个氨基酸的鼠源Piezo2表达量极低的困难,通过对蛋白纯化条件以及冷冻电镜制样方法的不断摸索和优化,最终获得了性质稳定均一的蛋白样品用于冷冻电镜数据采集。在结构解析过程中,由于Piezo蛋白具有极高的柔性,为解析高分辨率结构带来极大的挑战。研究人员将Piezo2数据颗粒进行对称性扩展,并切割成三个部分独立计算,得到高分辨的各部分结构后再拼合成完整结构,克服了柔性问题,最终获得了整体分辨率为3.6-3.8Å的三维结构(图a),并成功解析了Piezo2蛋白包含38次跨膜螺旋区的完整拓扑结构(图c, d)。
研究者们发现,Piezo2通道的整体三维结构和之前所解析的Piezo1通道类似,以同源三聚体形式组装成包含114次跨膜螺旋区的三叶螺旋桨状结构(图a-d),确立了Piezo通道是迄今已知的含跨膜次数最多的一类大型膜蛋白。其中第1到第36次跨膜螺旋区(TM1-36)依次以4次跨膜螺旋区为单元组装成共9个重复性的结构单元,这一特征性结构单元之前以清华大学英文缩写命名为THU (Transmembrane Helical Unit,跨膜螺旋单元) (图c, d)。非常有意思的是这9个THU串联组成一个特殊的非平面的跨膜“桨叶”(Blade)结构,导致三个桨叶围合成一个直径28 nm而深度10 nm的往细胞内侧凹陷的穹顶状结构(图b)。研究者推测这一穹顶状Piezo蛋白-细胞膜系统可能是Piezo通道具有高度机械敏感性的结构基础之一。
位于中心孔道区域上方的胞外“帽子”(Cap)结构域完全嵌在穹顶底部 (图a, b),而细胞内侧则有一根9 nm长的长杆区结构(Beam)将桨叶的外周端连接到中心孔道的胞内部位 (图a-e)。第38次跨膜螺旋(取名为inner helix,IH)和尾随的胞内羧基端结构域(CTD)围绕形成中心孔道部分(图e, f),包含位于跨膜区和胞质区的狭窄颈部(图f, g),提示该Piezo通道结构处于关闭态。Piezo2与Piezo1的结构比较表明,跨膜区狭窄位点在Piezo2结构中处于完全关闭状态,而在Piezo1中则处于开放状态(图f, g)。据此,研究者提出该狭窄位点形成跨膜区的开关闸门(TM gate) (图f, g)。进一步结构分析和电生理功能实验表明该闸门可能通过顶端帽子结构域的旋转来控制(图h)。而由于位于胞质区的狭窄颈部(cytosolic constriction neck)在Piezo1和Piezo2结构中都处于关闭状态(图f, g),因此该位点是否作为另一个开关闸门而被桨叶和长杆结构的构象变化所控制还有待进一步证明。
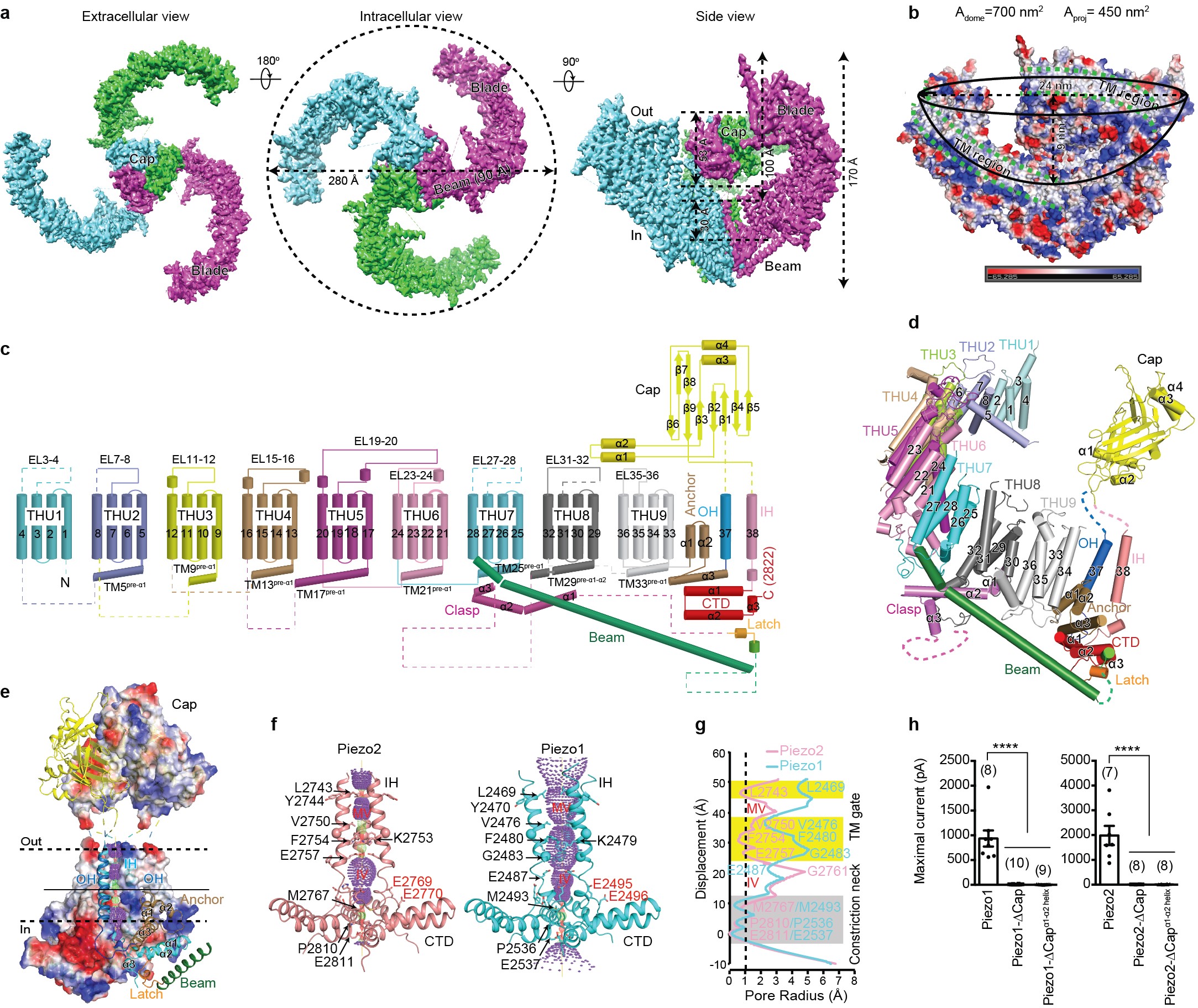
图
a,Piezo2的冷冻电镜示意图,其中每一个亚基用不同的颜色表示;
b,三个向外扭曲的跨膜桨叶区围成的穹顶状结构示意图,绿色虚线所标记的为跨膜区;
c,含38次跨膜区的Piezo2拓扑结构示意图;
d,Piezo2一个亚基结构组成展示图;
e,Piezo2中心孔道模块区;
f,由IH-CTD围绕而成的Piezo2与Piezo1的中心孔道区;
g,Piezo2与Piezo1中心孔道区的半径分布图,包含跨膜区开关闸门(TM gate)以及胞内区狭窄颈部(Constriction neck);
h,缺失帽子区的Piezo1与Piezo2突变体缺失机械刺激诱发的电流。
肖百龙博士表示,通过与李雪明博士课题组的通力合作,从Piezo1到Piezo2结构的解析不仅有力推动了对哺乳动物机械门控Piezo通道的结构和机械门控机制的理解,也为探究Piezo通道的功能失常所引发的人类疾病机理及其相关药物的鉴定发现提供了坚实的基础。依托其课题组已经建立的Piezo通道的全方位研究平台和学术积累,他们将致力于Piezo通道的药物发现与开发工作。
清华大学药学院肖百龙博士和生命科学学院李雪明博士为本论文共同通讯作者。清华大学药学院博士后王莉、生命学院2015级博士生周珩、2013级博士生张明敏及2016级博士生刘文豪为并列第一作者。此外,肖百龙课题组的博士生邓团、赵前程(现耶鲁大学博士后)、李祎然也参与了部分研究工作。清华大学冷冻电镜平台的雷建林博士为冷冻电镜数据收集提供了帮助。
本研究得到了科技部国家重点研发计划(2016YFA0500402,2016YFA0501102,2016YFA0501902)、国家自然科学基金委杰出青年科学基金以及重点项目(31825014, 31630090,31570730)、清华-北大生命科学联合中心、北京结构生物学高精尖创新中心以及生物膜国家重点实验室的资助,同时得到了清华大学冷冻电镜平台、清华大学高性能计算平台以及国家蛋白质设施实验技术中心(北京)的支持。
原文链接:https://www.nature.com/articles/s41586-019-1505-8.pdf
