清华大学药学院肖百龙课题组与生命学院李雪明课题组合作在《神经元》发文揭示机械门控Piezo离子通道的“门塞和闩锁
三月 08, 2020
2020年3月5日,清华大学药学院肖百龙课题组与生命学院李雪明课题组在神经科学领域权威学术期刊《神经元》(Neuron)在线刊登了题为《机械门控Piezo离子通道的“门塞和闩锁”门控机制》的研究论文,揭示了Piezo通道利用类似门塞和闩锁的作用原理对其胞内侧离子通透路径进行门控的精巧分子机制,并鉴定发现一种因缺失“门塞”结构元件而获得机械超敏性的新型Piezo1剪切变体亚型。该研究成果不仅有力促进了我们对机械门控Piezo通道如何将机械力刺激转化为电化学信号这一核心问题的理解,也将有助于对其功能性质的针对性改造与干预,为最终实现基于Piezo通道的生物技术开发,药物发现以及疾病治疗奠定基础。

机械门控Piezo离子通道是一类能够快速响应机械力刺激并介导阳离子流入细胞、进而诱发细胞兴奋和信号转导的一类重要离子通道,在哺乳动物细胞中包含Piezo1和Piezo2两个成员 (Coste et al., Science 2010; Coste, Xiao et al., Nature 2012)。Piezo1被发现在多种细胞组织中作为机械力分子受体参与调控血管及淋巴管发育、血压稳态维持、骨的生成与重塑等诸多功能;而Piezo2则介导哺乳动物的触觉、本体觉(譬如体位平衡感知)以及内脏觉(譬如肺的收缩扩张以及血压感知和心率调节)的机械感知。Piezo基因的遗传突变被发现引起多种人类遗传疾病,包括红细胞干瘪综合症、淋巴管水肿、远端关节挛缩症、触觉缺失症等。携带Piezo2功能缺失型突变的人体不仅表现出触觉以及本体感觉缺陷,且丧失病理状态下的机械超敏痛感知,确证Piezo2通道可以作为开发新型镇痛药物的重要靶点。
肖百龙博士课题组近年来综合利用生化结构、电生理膜片钳、高通量药物筛选、转基因小鼠模型以及人类遗传学等多学科研究手段,聚焦解答机械门控Piezo通道如何将机械力刺激转化为电化学信号,以及其如何利用自身机械敏感性和通道特性来决定相关的生理病理功能这两方面的关键科学问题,并致力于开发以Piezo通道为靶点的新型药物及技术。迄今在Piezo通道的三维结构解析(Nature 2015, 2018,2019)、分子机制揭示 (Neuron 2016;Nature Communications 2017)、小分子药物发现(Nature Communications 2018)、以及生理病理功能探索(Cell Reports 2019;eLife 2019)等方面取得了系列重要研究成果。肖百龙博士获邀为2020年度Annual Review of Pharmacology and Toxicology (2020 Jan 6;60:195-218) 撰写了年度综述文章,系统介绍了Piezo通道在近10年所取得的重要研究进展以及其作为新型药物靶点进行药物开发的重要前景和策略。
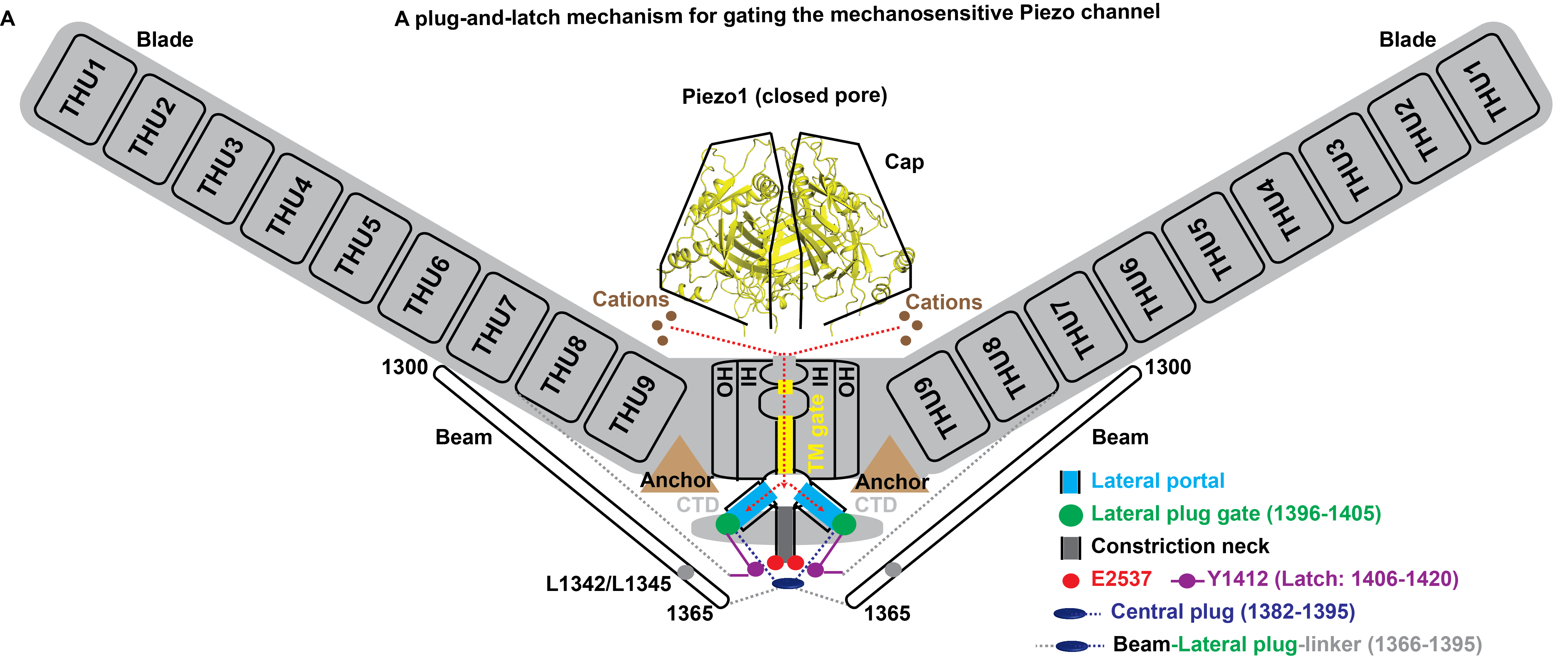
肖百龙课题组与李雪明课题组合作,于2018年与2019年在《自然》期刊相继报道了鼠源全长Piezo1与Piezo2的三叶螺旋浆状结构及工作机制,揭示了其以三聚体共计114次跨膜螺旋区的方式组装成含跨膜螺旋区最多的大型膜蛋白复合体,发现了决定其机械敏感性以及离子选择性的独特结构基础,为分析其响应机械力刺激而导致通道开放的热力学过程提供了准确参数,并创新性提出其行使机械门控的杠杆作用机制假说以及双门控作用机制假说。他们认为Piezo通道的离子通透路径上存在两处开关闸门,其中位于跨膜区的开关闸门通过位于孔道正上方的胞外的帽子区的旋转运动来控制,而位于胞质区的开关闸门则可能通过桨叶和胞内侧长杆结构以类似杠杆作用原理来控制(图A)。
然而Piezo通道的胞质侧的确切离子通透路径、开关闸门位点、以及门控机制都不清楚。
在最新的这篇《神经元》论文中,研究人员综合利用基于结构分析的定点突变、膜片钳电生理功能研究、新型剪切变体的鉴定发现等多种研究手段,确定了Piezo通道胞内侧的三个侧向离子通透路径(lateral portal)、以物理方式堵塞侧向离子通透路径的侧向门塞结构元件(lateral plug gate)、以及对侧向门塞进行控制的“闩锁”元件(latch) (图A)。结合对这些关键元件的功能研究,他们获得了系列实验数据来帮助其首次提出Piezo通道利用这些关键功能元件以类似“塞子和闩锁”的物理方式来调控侧向离子通透路径的关闭与开放的精巧分子作用机制。
首先,结构分析提示Piezo通道的胞内侧可能存在垂直方向或侧向这两种可能的离子通透路径 (图A)。研究人员通过对侧向离子通透路径上的9个氨基酸位点进行定点突变,成功将阳离子选择性的Piezo1通道改造成了一个阴离子选择性的通道。而对垂直方向的氨基酸进行突变并不引起离子选择性的改变。这些研究结果佐证了Piezo1通道利用其胞内侧的三个侧向通透路径(lateral portal)来通透阳离子。
其次,他们通过结构分析发现三个侧向路径的胞内开口处被一段氨基酸序列以物理形式堵塞(图A)。电生理功能研究发现如果把这一段氨基酸去除,单通道电导和机械敏感性都会显著增加,钙离子通透性也发生改变。基于这些结构功能分析结果,他们提出了这一段氨基酸序列形成侧向门塞结构(lateral plug gate)来调控侧向离子通透路径的开放与关闭。
非常有趣的是,研究人员鉴定发现了一种在多种细胞组织都有表达的全新的Piezo1剪切变体,其所缺失的一段序列正好包含了侧向门塞结构序列,他们把这一剪切变体命名为Piezo1.1(图B)。电生理功能研究发现Piezo1.1剪切变体的通道性质与缺失侧向门塞结构序列的突变体一样,具有更大的单通道电导和更为灵敏的机械敏感性。Piezo1.1是目前已鉴定发现到的对机械力最为敏感的Piezo通道家族成员。非常惊奇的是他们进一步发现之前所报导的Piezo2的一个剪切变体也正好缺失侧向门塞结构这一保守序列,提示Piezo1和Piezo2两个基因都利用选择性剪切的方式来调控侧向门塞这一关键结构域来调控其通道性质。
为了证明Piezo1.1剪切变体功能的改变确实是因为在结构上缺失了侧向门塞结构所引起,他们解析了Piezo1.1剪切变体的冷冻电镜三维结构。与他们的假设相吻合,Piezo1.1剪切变体缺失了侧向门塞结构,导致侧向离子通透路径的开口处处于完全开放状态。
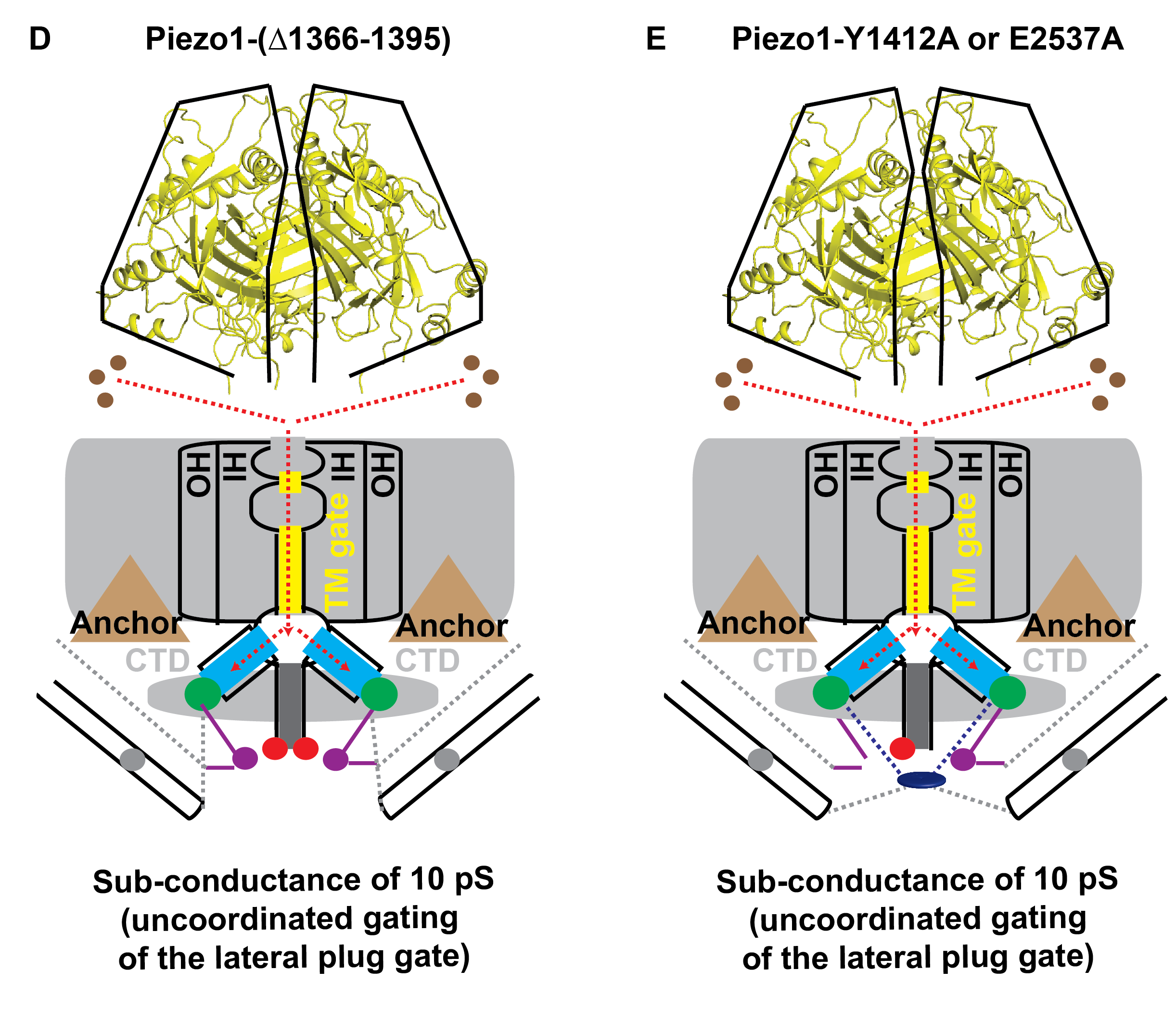
研究人员进一步探索了三个侧向门塞如何协同调控三条侧向离子通透路径。结构分析发现,三个侧向门塞结构被位于其前后两段的结构序列锚定到Piezo1通道胞内侧正中轴上,形成类似闩锁结构(latch)来协同控制三个门塞结构(图A)。单通道记录发现破坏Piezo1这一组装方式的突变体会产生亚电导(sub-conductance)开放,而且非常有意思的是亚电导的大小恰好是全电导的三分之一,提示三条通透路径以量子化而非协同的方式开放(图C, D)。
以上研究揭示了Piezo通道这类生物机械传感器的精细结构组装方式及精巧的机械门控机制,以及自然进化对这一结构和机制的精妙调控。
清华大学药学院肖百龙博士和生命学院李雪明博士为本论文共同通讯作者。清华大学药学院博士后耿洁(现就职于北京中医药大学),生命学院2016级博士生刘文豪, 2015级博士生周珩,肖百龙课题组张廷鑫博士(现美国MD安德森癌症中心博士后),药学院博士后王莉为并列第一作者。另外,肖百龙课题组的张明敏博士(现美国密歇根大学博士后),博士生李祎然,李雪明课题组的沈铂也参与了部分工作。
本研究得到了国家自然科学基金委杰出青年科学基金、重点项目、以及科技部重大研发计划(31825014, 2016YFA0500402, 31630090, 2015CB910102, 31570730, 2016YFA0501102, 2016YFA0501902, 2016M601003)、国家万人计划暨科技创新领军人才项目、清华-北大生命科学联合中心、北京结构生物学高精尖创新中心、生物膜国家重点实验室的资助。同时得到了清华大学冷冻电镜平台、清华大学高性能计算平台和国家蛋白质设施实验技术中心(北京)的支持。

机械门控Piezo离子通道的的“门塞和闩锁”门控机制示意图
(A)Piezo通道关键结构元件示意图。
(B)Piezo开放时跨膜区闸门(TM gate)可以被位于其正上方的Cap结构元件的旋转运动所打开,侧向门塞元件则可能被Blade-Beam结构元件所传递的机械力以类似拔门塞的方式部分打开,导致侧向离子通透路径的阳离子流通。
(C-E)侧向塞子被移除(C)或者由于突变造成闸门不协调(D,E)的情况下,侧向门塞的门控模式的改变导致通道特性的改变。
图中红虚线和红实线分别代表离子通透路径的关闭和开放。
原文链接:https://www.cell.com/neuron/pdfExtended/S0896-6273(20)30109-4
博士后招聘:肖百龙博士实验室常年招聘有神经科学、生理学、离子通道研究背景的优秀博士后。有意者请联系: xbailong@mail.tsinghua.edu.cn

