2019年2月5日,清华大学药学院饶燏课题组与中科院生物物理研究所姬广聚组及北京大学肖瑞平、张秀琴组合作在Cell discovery《细胞发现》期刊在线发表了最新研究成果《基于化学手段实现从小鼠到非人灵长类的全身蛋白敲低》(A Chemical Approach for Global Protein Knockdown from Mice to Non-human Primates)。该论文通过化学设计蛋白降解分子(PROTACs),快速可逆敲低动物体内蛋白(FKBP12),并首次成功实现恒河猴体内蛋白快速敲降。
动物的基因敲除是常见的研究手段之一。目前,常见的敲除手段如TALEN,Cre-LoxP,CRISPR-Cas9等是从基因组进行敲除,RNA干扰的方式则是从转录水平进行敲降。而这些方法通常在构建大动物基因敲除模型,尤其是非人灵长类上仍存在很大难度。此外,这些方法构建模型通常需要较长时间,且基因敲除引起的功能丧失多是不可逆的。而且基因敲除模型中潜在的基因补偿和/或自发突变可能导致功能误读。某些特定基因的全身性敲除会出现胚胎发育异常甚至死亡的现象,影响出生后的实验研究。
PROTAC(Proteolysis-Targeting Chimera)技术通过招募E3泛素连接酶,利用自身的泛素-蛋白酶体系统实现对靶向特定蛋白的降解。FKBP12(FK506 binding protein 12)是能与大环内酯类免疫抑制剂FK506和雷帕霉素特异性结合,并在哺乳动物中广泛表达的一类蛋白,该蛋白与钙离子通道受体-兰尼碱受体结合,使钙离子通道处于稳定的关闭状态,当FKBP12从RyRs解离后,RyRs开放,释放钙离子,从而通过钙信号通路实现对机体重要功能的调控。FKBP12重要功能之一是参与心脏发育,对心肌细胞表型分化、心脏结构形成和心脏搏动的启动发挥重要的调节作用。胚胎期心脏缺失FKBP12时会引起严重的发育性心室缺损,导致胚胎死亡。因此全身敲除FKBP12在成年鼠心脏中的功能研究还不完全,且并没有敲除大动物FKBP12的研究。
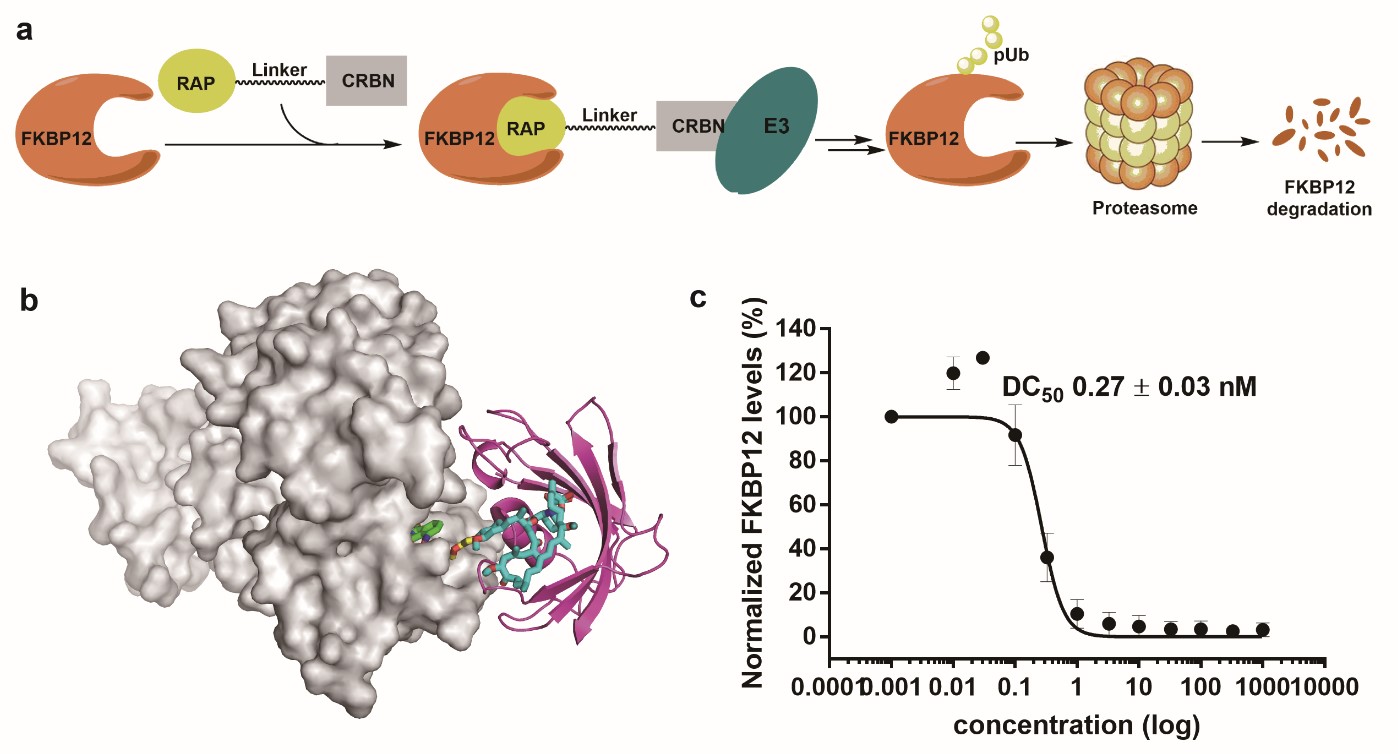
图1. PROTACs原理示意图及所设计分子活性测定
在本文中,首次利用PROTACs这一化学技术实现动物体内靶蛋白的全身敲低,快速构建了小鼠、大鼠、猪和恒河猴的FKBP12蛋白全身敲低模型,并在小鼠及恒河猴对FKBP12蛋白功能进行了研究和验证。其中小鼠及大鼠体内FKBP12蛋白仅用一天,香猪体内FKBP12仅用两天,恒河猴体内FKBP12仅用三天即可全身高效率全身敲低。此外,本文中首次验证PROTACs可在口服给药途径中保持高效蛋白降解功能。脑室给予PROTACs时可实现脑内FKBP12的条件性敲除。若停止给予PROTAC,则动物体内蛋白可逐渐恢复,这有利于动物模型自身对照,对于蛋白功能研究更为准确。本文还将此方法应用于其他靶蛋白的全身敲低,如BTK蛋白。因此,该PROTAC技术是当前基因敲除方法的有效补充,因其快速可逆可控实现体内外蛋白全身敲低,是极有应用前景。
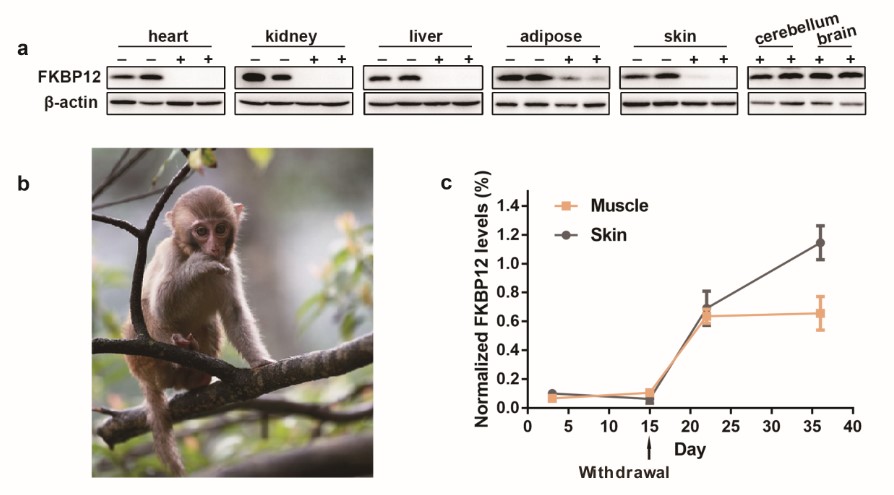
图2. 利用所设计PROTAC对恒河猴FKBP12全身敲低及停药后蛋白恢复
哈佛大学完美体育·(中国)官方网站魏文毅教授在Cell Research期刊上评论该工作时指出由于PROTAC技术是直接通过内源E3连接酶和泛素化系统将引起癌症的靶蛋白降解,因此该技术可以克服传统方法如CRISPR, RNAi和小分子抑制剂的不足,是引领新一代医药开发的新技术。目前FDA已经批准第一例口服PROTAC(ARV-110)进入临床一期研究,通过降解雄激素受体治疗前列腺癌。但目前缺乏对PROTAC的系统研究及动物层面的临床前研究,尤其是大动物上的评价。所以该工作实现了PROTAC技术从小鼠、猪到恒河猴的系统探索,填补了PROTAC技术临床前研究的空白,为其应用于临床治疗人类肿瘤提供了指导,奠定了坚实基础,同时为体内蛋白功能研究提供了一种新颖、高效、快速、可逆且低成本的强有力工具。

图3. 从DNA, RNA和蛋白质水平抑制肿瘤相关基因的策略总结
清华大学饶燏教授和姬广聚教授,张秀琴教授为本论文共同通讯作者。饶燏课题组、清华-北大生命联合中心博士后孙秀云、中科院生物物理所博士生王珺及饶燏课题组博士生姚霞为本文并列第一作者。该研究得到了国家自然科学基金和国家重大新药创制项目的大力支持。
原文链接:https://www.nature.com/articles/s41421-018-0079-1
