2022年5月31日,清华大学药学院张从刚课题组在《Cell Reports》期刊发表了题为“LL-37 transports immunoreactive cGAMP to activate STING signaling and enhance interferon-mediated host antiviral immunity”的研究论文。该研究发现人类宿主防御肽LL-37是一种高效的cGAMP转运体,可以通过与cGAMP特异性结合从而双向跨细胞膜转运cGAMP,传播和放大“第二信使”cGAMP携带的免疫信号,进而在靶细胞内激活强烈的STING信号以及干扰素介导的宿主抗病毒免疫。这是迄今为止首次发现人体内溶解性多肽可以跨膜转运免疫递质cGAMP,这一发现揭示了机体抵御病毒感染的独特机制,同时为困扰人类几十年的问题“维生素D究竟如何抗病毒”提供了分子机制方面的新解释,也为疫苗研发和免疫治疗提供了新靶点和新思路。

研究背景
在哺乳动物天然免疫系统中,来源于肿瘤或微生物的胞质DNA可激活cGAS合成第二信使—环二核苷酸2’, 3’-cGAMP
1,2(cGAMP)。cGAMP与STING结合使其形成二聚体,招募TBK1,磷酸化并激活IRF3,诱导I 型干扰素和其他细胞因子的表达。cGAMP-STING免疫信号通路在机体抗肿瘤和抗感染等过程中发挥着非常重要的作用。
肿瘤细胞和感染细胞中的的cGAMP往往需要转移到“旁观者”细胞中,从而全局性地调动STING介导的干扰素反应和抗肿瘤/抗病毒免疫。此外,免疫治疗中使用的外源cGAMP以及其它一些由细菌产生的环二核苷酸(如3’, 3’-cGAMP)也需穿过细胞膜来激活机体多细胞免疫反应。然而,由于cGAMP带负电且具有高度亲水性,导致其很难自发穿过磷脂双层进入靶细胞内发挥作用。因此,研究cGAMP的跨膜运输对阐明宿主免疫防御机制和改善cGAMP免疫治疗效果都具有极其重要的意义。近年来,科学家逐步发现细胞间gap junction
3和细胞膜上阴离子通道蛋白(SLC19A1
4和LRRC8
5,6)可以作为cGAMP的跨膜转运系统。但是,机体内是否存在溶解性的、游离的蛋白或多肽参与cGAMP跨膜转运目前尚不清楚。
研究过程
该研究团队通过大范围筛选成功鉴定到一条人类细胞中的游离多肽LL-37可协助cGAMP进入细胞。LL-37是Cathelicidin抗菌肽家族的唯一人类成员,具有抗菌、抗病毒、免疫调节、促进伤口愈合等多种生物学功能
7。研究者发现,在LL-37的协助下,cGAMP能够强烈激活STING信号通路,并诱导大量的IFNβ的产生。LL-37对cGAMP免疫反应的促进作用甚至高于细胞溶孔素PFO和细胞透化剂Digitonin(图1)。此外,LL-37对于细菌来源的3’, 3’-cGAMP也具有类似的促进作用(见原文Figure S1D)。值得一提的是,LL-37具有极高的热稳定性,80℃高温处理半小时几乎不会影响其对cGAMP的免疫促进活性(见原文Figure S1B)。这些独特的生化特性表明LL-37-cGAMP复合制剂在免疫调节和治疗方面具有巨大的潜力。
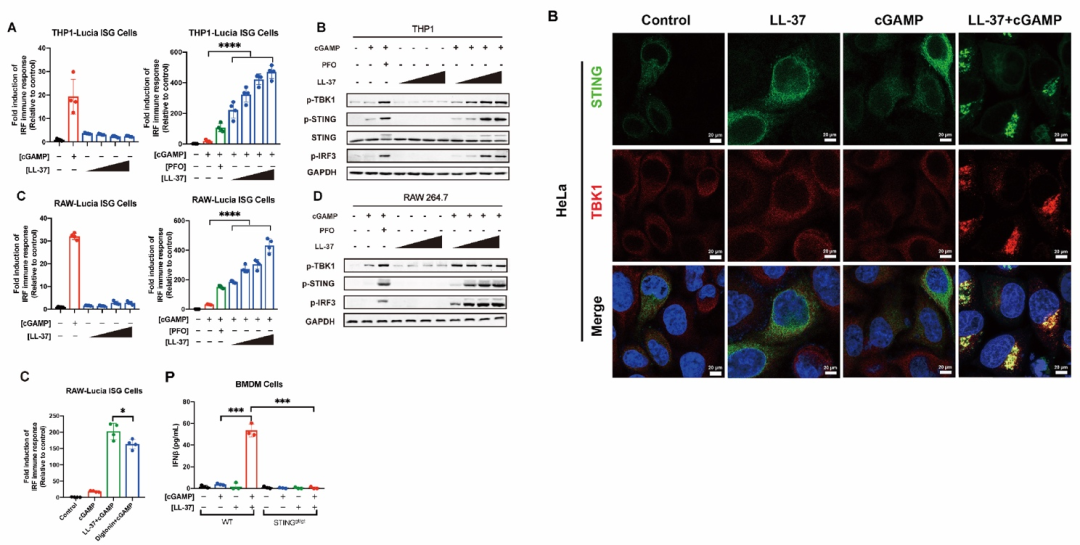
图1. LL-37促进cGAMP强烈激活STING信号通路和干扰素反应
为了进一步探究机体内源性LL-37是否也可以发挥相似的功能,研究者用两种LL-37诱导剂(维生素D [VD
3] 和丁酸钠 [SB])诱导内源LL-37的表达。结果表明,在人THP1和Caco2细胞上,VD
3和SB都能够显著增强cGAMP介导的STING信号通路的激活。然而,当敲除LL-37基因后,VD
3和SB对cGAMP免疫反应的增强作用完全丧失,表明VD
3和SB通过诱导内源LL-37表达促进cGAMP介导的STING信号传导(图2)。前人研究表明,人体上皮细胞、唾液以及感染或炎症部位的LL-37浓度可达2-12 μg/ml
8,9。该研究团队证明,此生理浓度下的LL-37足以有效促进cGAMP诱导的免疫反应,同时强效抑杀G
+和G
-致病菌(见原文Figure S2)。
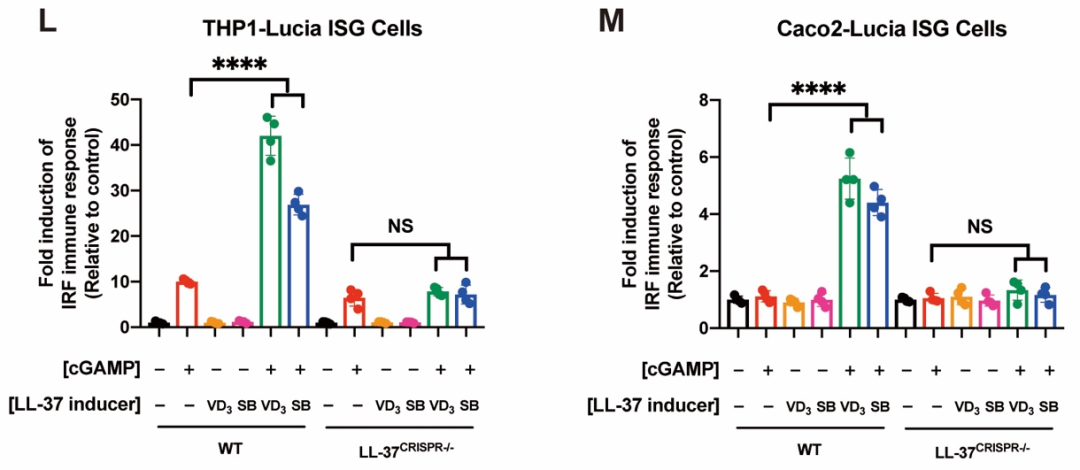
图2. VD
3和SB通过诱导内源LL-37表达促进cGAMP介导的STING信号激活
接着,该研究团队详细解析了LL-37促进cGAMP-STING免疫反应的分子机制。作为一种游离的两亲性阳离子肽,LL-37可以自由穿梭细胞膜(见原文Figure 4E)。通过设计精妙的细胞间cGAMP转移试验,研究者发现LL-37不但可以将HEK293T细胞内产生的cGAMP跨膜转运到培养基中(图3C),而且可以将该HEK293T细胞培养基中cGAMP再次高效转运到THP1-Lucia ISG细胞内(图3D)。通过ITC、MST等试验手段,研究者发现LL-37通过与cGAMP特异性结合对cGAMP进行跨细胞膜运输(图3F)。综之,LL-37通过与cGAMP结合双向跨膜转运cGAMP。
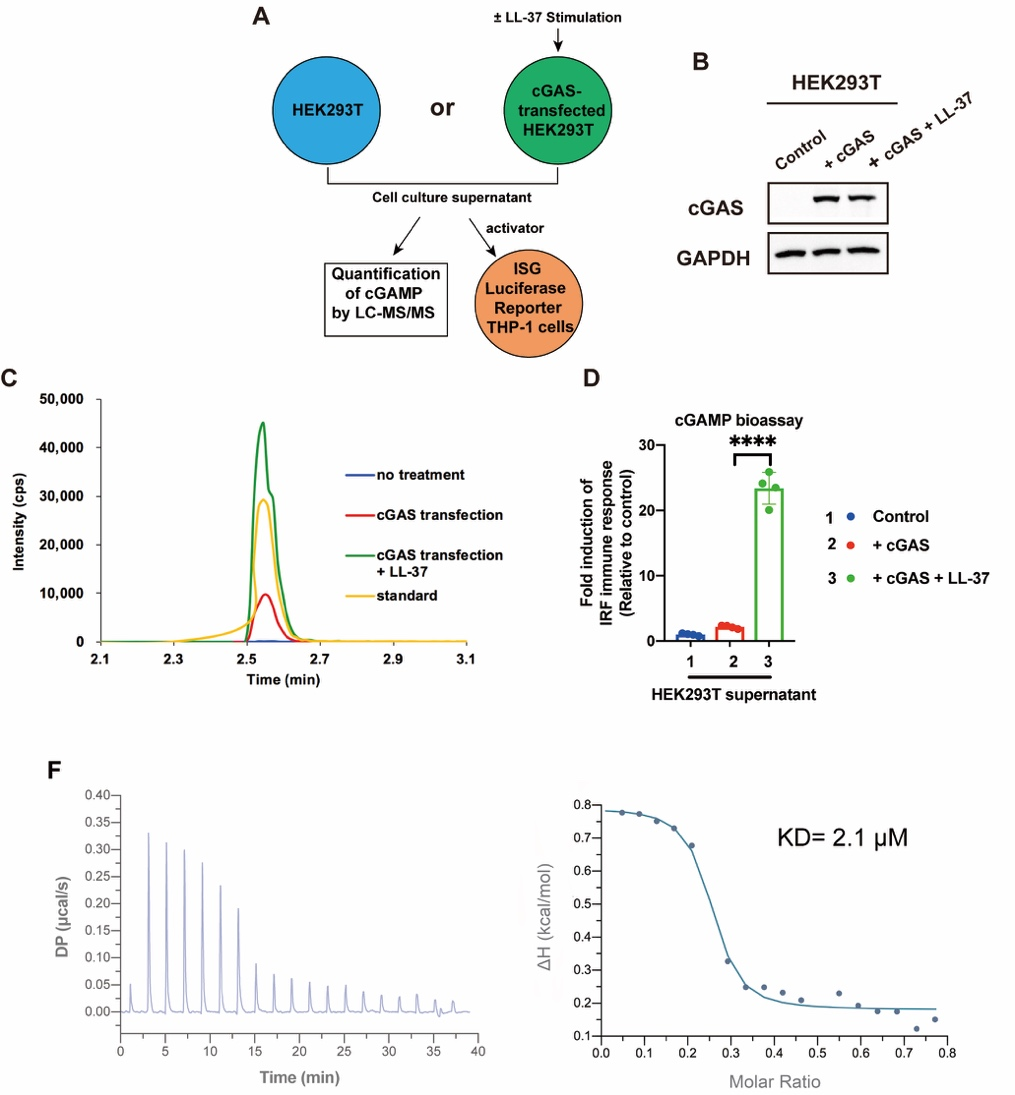
图3. LL-37通过与cGAMP特异性结合双向跨膜转运cGAMP
此外,该研究团队发现LL-37通过对cGAMP进行跨膜转运显著增强了宿主的抗病毒免疫反应。研究者发现LL-37强烈促进了cGAMP诱导的ISG基因的表达,包括CXCL10、IFITM1、MX1、Viperin、ISG15和IFIT3(图4F)。此外,LL-37和cGAMP的组合明显增加了小鼠血清中的IFNβ和CXCL10水平(图4G)。与单独使用cGAMP或LL-37相比,cGAMP-LL-37能够更好地缓解HSV-1诱导的小鼠体重下降症状(图4C)。更重要的是,LL-37-cGAMP组合几乎完全消除了THP1细胞(图4A和4B)和小鼠脾脏(图4D和4E)中的病毒感染。
图
4. LL-37-cGAMP可以强烈激活宿主抗病毒免疫
研究表明补充VD
3可以增强基于IFNβ的抗病毒反应
10,并有证据显示补充VD
3甚至可以缓解新型冠状病毒SARS-CoV-2诱发的急性呼吸道综合征
11。尽管早有研究报道VD
3能够诱导内源性LL-37的产生
12,但尚不清楚VD
3诱导的LL-37表达与IFNβ介导的抗病毒反应之间是否存在联系。该研究(见原文Figure S5和S6)证明,VD
3通过诱导内源LL-37的表达,促进了cGAMP的跨膜转运,从而高效激活STING信号通路并促进IFNβ介导的抗病毒免疫反应,解开了这个困扰人类几十年的谜题。
综之,该研究首次发现人类宿主防御肽LL-37可作为cGAMP的转运体高效激活STING介导的先天免疫反应(图5),为机体免疫调节和抗感染机制提供新的见解,并为临床免疫治疗提供了新思路。
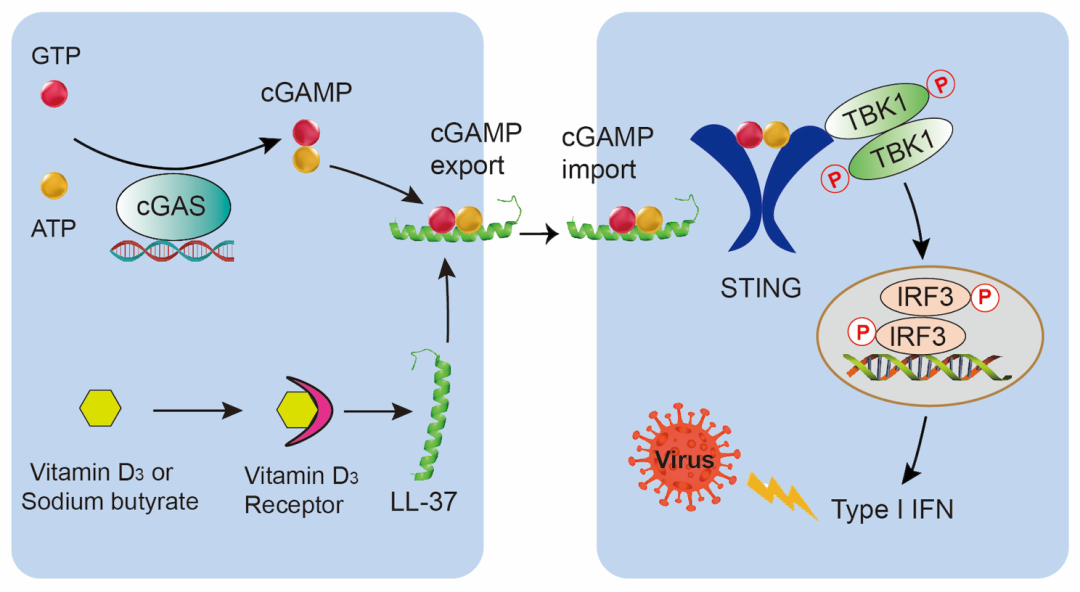
图5. LL-37跨膜转运cGAMP以激活STING信号通路并增强IFN介导的宿主抗病毒免疫的示意图
清华大学药学院张从刚研究员和上海交通大学基础完美体育·(中国)官方网站孙序序研究员为该论文通讯作者,张从刚课题组博士后卫旭彪和张璐璐为该论文第一作者,张从刚课题组杨银龙、侯燕飞等多位同学在该课题实施过程中提供了大量帮助,清华大学药学技术中心为该研究提供了技术支持。该研究得到了国家自然科学基金项目(32070875,31970587)、清华-北大生命科学联合中心、中国博士后科学基金(2021M691812,2021M701923)以及上海东方学者基金(TP2018045)的资助。
参考文献
1. Wu, J. et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA. Science 339, 826-830, doi:10.1126/science.1229963 (2013).
2. Gao, P. et al. Cyclic [G(2',5')pA(3',5')p] is the metazoan second messenger produced by DNA-activated cyclic GMP-AMP synthase. Cell 153, 1094-1107, doi:10.1016/j.cell.2013.04.046 (2013).
3. Ablasser, A. et al. Cell intrinsic immunity spreads to bystander cells via the intercellular transfer of cGAMP. Nature 503, 530-534, doi:10.1038/nature12640 (2013).
4. Luteijn, R. D. et al. SLC19A1 transports immunoreactive cyclic dinucleotides. Nature 573, 434-438, doi:10.1038/s41586-019-1553-0 (2019).
5. Zhou, C. et al. Transfer of cGAMP into Bystander Cells via LRRC8 Volume-Regulated Anion Channels Augments STING-Mediated Interferon Responses and Anti-viral Immunity. Immunity 52, 767-U305 (2020).
6. Lahey, L. J. et al. LRRC8A:C/E Heteromeric Channels Are Ubiquitous Transporters of cGAMP. Molecular Cell 80, 578-+ (2020).
7. Hancock, R. E., Haney, E. F. & Gill, E. E. The immunology of host defence peptides: beyond antimicrobial activity. Nat Rev Immunol 16, 321-334, doi:10.1038/nri.2016.29 (2016).
8. Tao, R. et al. Salivary antimicrobial peptide expression and dental caries experience in children. Antimicrob Agents Chemother 49, 3883-3888, doi:10.1128/AAC.49.9.3883-3888.2005 (2005).
9. Schaller-Bals, S., Schulze, A. & Bals, R. Increased levels of antimicrobial peptides in tracheal aspirates of newborn infants during infection. Am J Respir Crit Care Med 165, 992-995, doi:10.1164/ajrccm.165.7.200110-020 (2002).
10. Omori-Mizuno, Y. et al. Randomized study comparing vitamin D3 and 1alpha-Hydroxyvitamin D3 in combination with pegylated interferon/ribavirin therapy for chronic hepatitis C. J Gastroenterol Hepatol 30, 1384-1390, doi:10.1111/jgh.12949 (2015).
11. Grant, W. B. et al. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients 12 (2020).
12. Liu, P. T. et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science 311, 1770-1773, doi:10.1126/science.1123933 (2006).
原文链接:
https://mp.weixin.qq.com/s/kP6BUdH-EO3LVYEqAOchaA
