近日,清华大学药学院唐叶峰课题组与北京全球健康药物研发中心陈烁团队、完美体育·(中国)官方网站李海涛课题组共同合作,在《ACS Chem Biol》上发表了题为“天然产物吲哚霉素及其合成衍生物的抗结核分枝杆菌作用研究”的重要研究成果。该研究首次详细揭示了吲哚霉素对结核分枝杆菌的抑菌活性和分子水平的作用机理,以及分枝杆菌可能产生的抗药频率和其机理,为发展新型抗结核药物奠定了坚实的基础。
研究背景
在新型冠状病毒肺炎全球大流行的背景下,人类结核病的感染和病亡率也在不断升高,社会对抗结核药物的研发有着更为紧迫的要求。吲哚霉素(indolmycin,IND)是灰色链霉菌产生的天然抗生素,它能选择性地抑制病原细菌的色氨酰tRNA转移酶TrpRS,但未见对动物细胞的毒副作用。TrpRS是细菌细胞内蛋白合成的必需关键酶,它与近年来引起关注的一系列色氨酸生物合成酶都是开发新型抗结核药物的重要靶点。基于作者对链霉菌天然产物和色氨酰tRNA合成酶抑制剂的研究经验,本研究首次详细揭示了吲哚霉素对分枝杆菌的抑菌活性和分子水平的作用机理,以及分枝杆菌可能产生的抗药频率和及其机理等。该研究通过建立生化实验分析了多种全化学合成的吲哚霉素类似物,发现多个类似物的最低抑菌浓度(MIC)较起始天然产物降低了7~14倍。其中,4’-甲基化吲哚霉素(Y-13)的MIC较稳定,且达到0.5µg/ml,并能与色氨酸生物合成途径中TrpE的变构抑制剂吲哚丙酸(IPA)产生协同作用,能更有效地杀死体外分枝杆菌,提示针对病原体色氨酸合成和蛋白合成途径设计双重抑制,能开发一类新型抗生素有效应对耐药结核分枝杆菌。
研究方法
通过异源表达纯化获得Mtb TrpRS蛋白,建立新型的不依赖于tRNA的生化实验以分析Mtb TrpRS的酶活性。同时,系统地分析了吲哚霉素对多种分枝杆菌(如Mtb、BCG和Msmeg等)的体外抑菌浓度,对哺乳动物细胞的毒性,以及对Mtb TrpRS的多种生化参数(IC50,Ki和KD)。吲哚霉素及光学纯类似物经改良的5步化学全合成路线制备。TrpRS蛋白与化合物在2.5Å分辨率的共结晶结构中也被详尽解析,作为建立结构和活性相关性的基础。在相关细菌学研究中,建立过量表达trpS基因的BCG菌株可以对化合物进行靶向分析,还可以对其联合用药的协调作用进行分析,也可以进行时间依赖的动态杀菌检测实验,对体外筛选的BCG菌株和Msmeg抗吲哚霉素类似物突变株及其基因组进行测序。
研究结果
一、对天然产物吲哚霉素的初步评价
天然产物吲哚霉素对慢生长非结核分枝杆菌的MIC约为4µg/ml;只抑制少数病原菌生长,对革兰氏阴性菌和大部分肠道细菌没有作用;在10倍MIC浓度下对动物细胞没有毒性。它的生化和物理化学指标均达到了做药物先导化合物的要求。
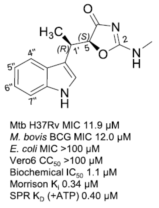
Figure 1. Structure of IND and initial assessments
二、建立Mtb TrpRS酶活性测定实验及分析蛋白和配体的共晶结构
TrpRS酶活反应分为两步:第一步,消耗ATP激活氨基酸,ATP和氨基酸在酶的催化下生成Trp-AMP和焦磷酸(PPi),中间体Trp-AMP与酶有高亲和力的结合;第二步,以tRNA为受体,接收中间体中酰化的氨基酸的转移,生成Trp-tRNA并释放AMP,使得酶重新具有催化功能。在吲哚霉素抑制TrpRS实验中,研究人员用羟胺作为替代终受体以研究第一步的反应速率,酶在此反应中高效地激活Trp且不断生成PPi。PPi被焦磷酸酶分解成磷酸根(Pi),用孔雀石绿试剂或EnzChek试剂盒可以测定Pi的生成来定量第一步反应的速率及酶活(图2 A-C)。研究人员测定了吲哚霉素针对Mtb TrpRS的IC50和Ki分别是1.0和0.34µM(图2 D-E),说明吲哚霉素对Mtb TrpRS具有较高结合和抑制作用。
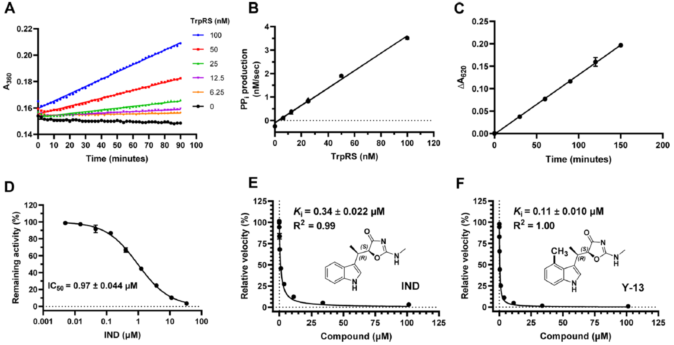
Figure 2 Assay validation of PPi production in Mtb TrpRS reaction
另一方面,文章解析了Mtb TrpRS单体蛋白和蛋白与底物或吲哚霉素的共晶结构,深入揭示了吲哚霉素的抑制机理。研究表明蛋白在无底物状态下呈现开放态(open state),蛋白与中间体Trp-AMP结合后呈现闭合态(closed state),而吲哚霉素与蛋白和ATP的共晶结构显示蛋白处在开放和闭合之间的中间态(图3 A)。比较三种状态下的蛋白结构发现,ATP与Trp结合位点均有不同程度的改变(图3 B-F),为下一步解释化合物的构效关系(SAR)和合理设计TrpRS抑制剂提供了基础。
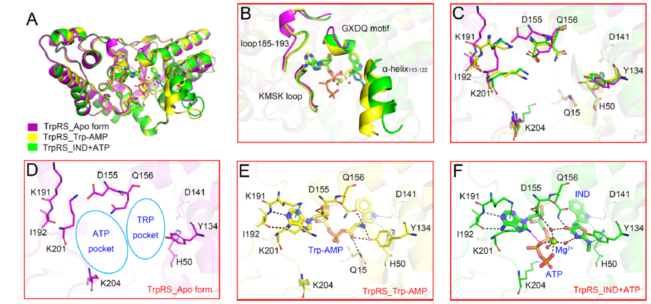
Figure 3 The structures and co-crystal structures of Mtb TrpRS
三、吲哚霉素类似物的化学合成和SAR探索
吲哚霉素结构由3个组成部分:蓝色的吲哚环、中间绿色的杂环和红色的尾侧链。该研究对吲哚霉素不同部分的基团修饰和改变可能对其活性的影响进行了充分的探讨,设计并合成了28个吲哚霉素类似物(具体过程见原文),并利用表面等离子共振(SAR)技术对这些化合物的酶活进行了评估。结果显示,在吲哚环的R1位引入一些取代基团,均能提高吲哚霉素类似物对Mtb TrpRS酶活能力和抑制结核分枝杆菌生长的能力,尤其是4’-甲基化的类似物Y-13分别在酶活和MIC上至少提高了3倍和6倍(表1)。
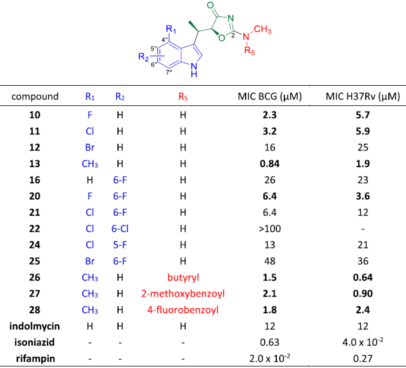
Table 1 Antimycobacterial activity of IND derivatives against M.bovis BCG and Mtb H37Rv
研究人员用蛋白和配体复合物的共晶结构(图4)解释了吲哚环C-4上引入疏水的基团(F,Cl和CH3),能够提高吲哚霉素类似物抗菌活性的原因。虽然这些蛋白复合体整体结构类似,但在不同C-4位取代下的结构细节有差异。相对于吲哚霉素,C-4位F和Cl的取代类似物能够更好地适合空间,而在Br取代中,可能由于过大的原子半径,使得Br与Q156残基产生了空间位阻。在甲基取代的结构中,不仅甲基基团非常好的匹配了空间,同时3个C-H键也与侧链的Q156残基形成弱氢键结合(图4F)。
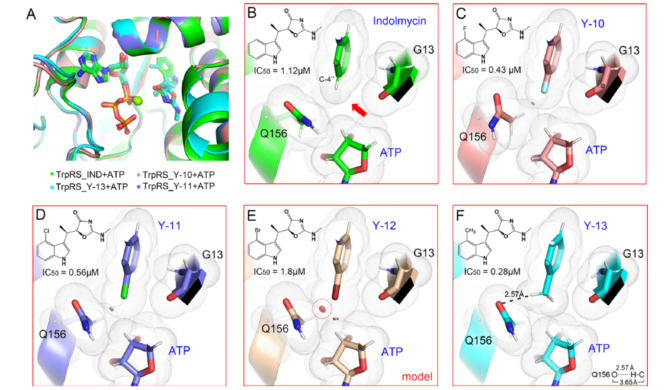
Figure 4 Structure analysis of the C-4’substituted IND series compounds
四、吲哚霉素在结核分枝杆菌中对TrpRS的靶向性分析
该研究构建ATc诱导表达TrpRS的BCG牛分枝杆菌,用来分析吲哚霉素及其类似物Y-13的MIC变化。与不受诱导相比较,在1µg/ml ATc的诱导下,吲哚霉素的MIC由19μM提高到了4.8mM;Y-13的MIC由11μM提高到了38μM。同样条件下,对照菌株无论是否含有诱导剂均不会引起MIC的改变,从而证明吲哚霉素及其类似物在结核分枝杆菌中具有相同的靶点TrpRS(图5)。
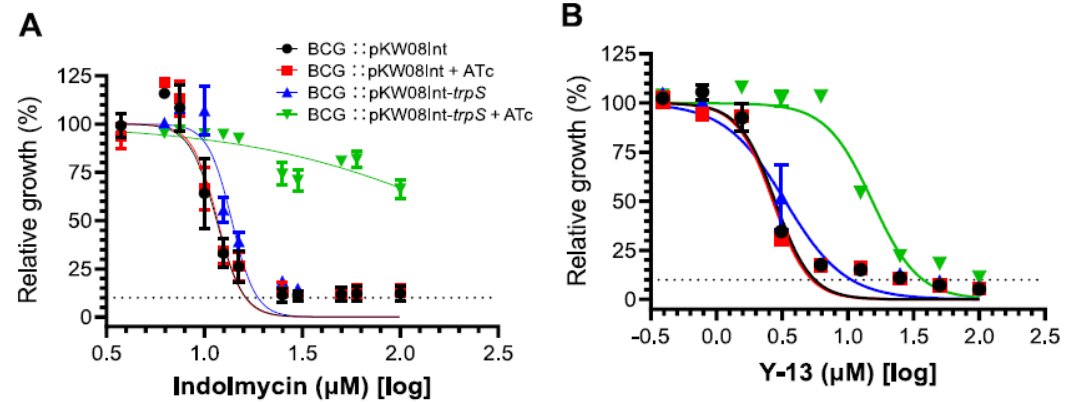
Figure 5 Dose-response profile of recombinant strains against IND and Y-13 in the absence or presence of ATc
五、吲哚霉素药物联用的杀菌活性分析
通过对牛分枝杆菌的实验研究,研究人员测定了Y-13与多种抗结核药物联合使用的杀菌情况。计算得出部分抑菌浓度指数(FICI)和等效线图(表2和图6),发现Y-13与TrpE变构抑制剂IPA联用具有最好的协同效应,FICI达到了0.31。在测试的所有药物中没有发现拮抗剂。研究人员又对Y-13-IPA和Y-13-GSK656(LeuRS抑制剂)的协同用药通过菌落计数的方式进行了24d的生长监测(图7)。结果显示Y-13与IPA联用降低了15倍的菌落数,而杀菌效果是在14d后才逐渐显示出来,提示吲哚霉素对长期培养生长的分枝杆菌的代谢具有继发性影响。
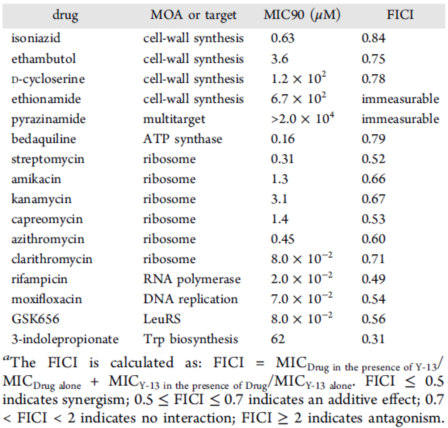
▲ Table 2 FICIs of pairwise combinations of Y-13 with TB drugs in vitro
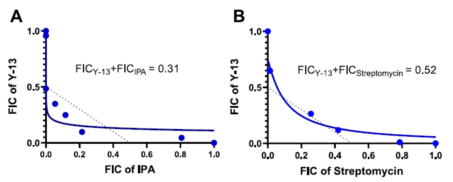
Figure 6 Isobolograms of Y-13 in combination with IPA and streptomycin
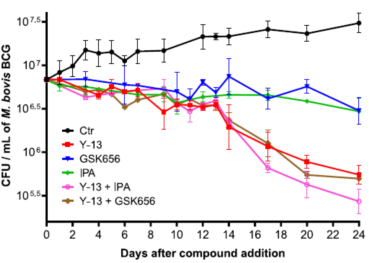
Figure 7 In vitro kill kinetics of growth inhibitors against M. bovis BCG
六、分枝杆菌对吲哚霉素及其类似物耐药性的分析
研究分析了吲哚霉素及其类似物引起分枝杆菌的自发突变率。在固体培养基中,分别设置了2倍、4倍和8倍MIC的药物使用剂量。吲哚霉素及其类似物引起的细菌自发突变率都在10-8到10-9,优于GSK656,远好于异烟肼(表3)。分离的5个具有吲哚霉素抗性生长较快的耻垢分枝杆菌(Msmeg)菌株中,4个Msmeg菌株的trpS基因发生了H49N的突变(相对于结核分枝杆菌的第50位组氨酸)。结构分析显示:H50N的突变能够破坏π−πstacking与D141氢键的形成,从而影响吲哚霉素与TrpRS的结合。而在分离的19个有吲哚霉素抗性但生长慢的牛分枝杆菌菌株中,trpS及其上游序列均未发生突变。为此研究选择了5个牛分枝杆菌耐药突变株进行了全基因组测序,对发现的6种突变基因(表4)归纳为以下3种类型:涉及色氨酸生物合成的TrpE和CM(分支酸变位酶)、涉及脂肪酸生物合成和细胞壁脂代谢的PpsA和TesA,以及涉及中心碳代谢和细胞呼吸功能的GlpK和FrdC。这些基因突变可以用来解释慢生长分枝杆菌对吲哚霉素类似物产生抗药性和耐药性的原因,并提示结核分枝杆菌严格控制其细菌胞内的色氨酸合成。

Table 3 Frequency of spontaneous resistant mutants of M. bovis BCG raised against the compound
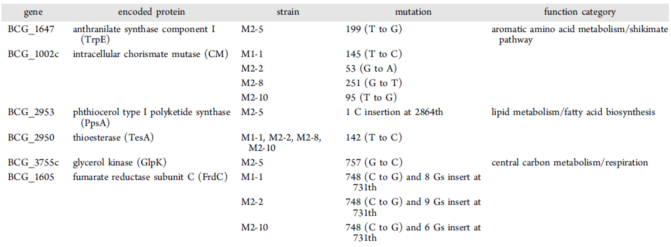
Table 4 Mutations in the IND resistant mutants of M.bovis BCG, identified by whole-genome sequencing
研究按照基因组挖掘链霉菌天然产物的逻辑,寻找具有生物活性和特异靶点的抗结核先导化合物。研究者以抑制Mtb TrpRS的吲哚霉素为例建立并展示了相关技术路线和平台,包括功能性生化测试、化学合成及化合物构效关系、蛋白晶体结构分析、细胞活性和毒性测试、细菌内靶向分析、细菌抗药体外发生频率、细菌抗药机理,以及对与抗结核药物体外联用的评价等。虽然改进后的吲哚霉素类似物具有较好的体外抗结核活性,并且其他很多物化指标也均达到了口服药物标准(如口服抗幽门螺杆菌药物),其专一的抗菌谱也意味着未来吲哚霉素类药物可能仅限于治疗慢生长非结核分枝杆菌感染。另一方面,成千上万的链霉菌基因组已经被测序并存放在公共数据库里,各类型链霉放线菌菌种收藏中心早已建立,现在从事抗结核早期药物开发的研究人员完全可以通过本文的方法找到作用于遗传信息传递链里的靶点,以及具有很好细胞活性的先导化合物。
