近日, 清华大学药学院肖百龙团队揭示了Piezo1作为星形胶质细胞的机械传感器,可以将机械信号转换成化学信号,通过影响ATP释放参与调节海马成体神经发生和认知功能的重要作用,为机械信号转导参与调控大脑组织稳态提供了证据。

大脑的正常功能与稳态维持依赖于包括神经元、神经胶质细胞、脑血管等多种细胞对脑环境中的各种信号有效转导和协同作用。大量研究表明电压门控或配体门控离子通道所介导的电、化学信号转导机制在大脑发育、功能、以及疾病发生发展中起着至关重要的作用。然而大脑的稳态维持是否依赖机械门控离子通道所介导的机械信号转导则并不清楚。
为了解答这一科学问题,研究人员首先利用融合表达Piezo1-tdTomato的报告基因小鼠确定了大脑中表达机械门控通道Piezo1的细胞类型。有意思的是,除了之前已经发现的表达Piezo1的血管内皮细胞外,Piezo1在星形胶质细胞中广泛表达。进一步的研究显示,Piezo1不仅定位于细胞胞体,在星形胶质细胞的触手以及脚板结构中也有广泛的分布,这些结果表明星形胶质细胞中Piezo1可能发挥独特的机械感知生物学功能。
星形胶质细胞作为哺乳动物脑内数量最多、分布最广泛的细胞类型,具有典型的多级分枝结构,其形成的网络能够覆盖极大的组织微环境(每个星形胶质细胞体积约为13000 μm3),赋予其有效监测大脑稳态的形态结构。因此研究者推测,星形胶质细胞能够利用Piezo精细的机械敏感特性感知大脑微环境中微弱的机械信号,从而参与大脑活动。
利用星形胶质细胞特异性Piezo遗传修饰小鼠,体外分离培养Piezo敲除的星形胶质细胞,发现Piezo1直接介导了星形胶质细胞对机械力刺激的响应,诱发阳离子电流和胞外Ca2+的内流。在分子机制上,星形胶质细胞Piezo1通过响应机械力刺激最终调节ATP的释放。虽然之前的研究已经报道星形胶质细胞在机械力刺激下可以通过Connexin/Pannexin等通道释放ATP,研究者利用电生理、钙成像等技术结合药理学工具,证实Piezo1作为上游信号分子响应机械力刺激,进而调节下游ATP的释放,建立了在星形胶质细胞中从机械信号到化学信号的直接联系。
为了进一步揭示星形胶质细胞Piezo在组织细胞水平中的作用,研究者以成体神经发生微环境为切入点,探究了星形胶质细胞Piezo敲除对海马成体神经发生可塑性的影响。研究人员发现,在星形胶质细胞中特异性敲除Piezo1通道的小鼠表现出现严重的海马体积缺陷(图1)。进一步的分析发现,星形胶质细胞Piezo敲除显著抑制了海马神经干细胞的增殖,导致包括神经前体细胞、非成熟神经元、成熟神经元以及星形胶质细胞数量的明显减少。值得注意的是,星形胶质细胞Piezo敲除导致的海马成体神经发生的缺陷可以通过外源添加ATP进行挽救,从而进一步证实星形胶质细胞Piezo通过影响ATP释放的分子机制。
研究人员利用活体脑片对长时程增强(LTP)进行分析,发现星形胶质细胞Piezo敲除小鼠海马的LTP与对照相比显著下降,而添加ATP则可以挽救Piezo敲除小鼠LTP的缺陷。
通过在动物整体水平对星形胶质细胞Piezo敲除小鼠行为学分析发现,Piezo敲除小鼠在水迷宫以及Y迷宫测试中表现学习和记忆功能下降,表明星形胶质细胞Piezo在调控大脑认知功能中发挥了重要的作用。
最后研究人员利用星形胶质细胞Piezo1过表达小鼠,证实了星形胶质细胞中Piezo1通道通过增强机械信号转导、增强了突触可塑性和认知功能,从充分性和必要性两个方面证实了机械敏感通道Piezo在大脑功能稳态维持中的重要作用。(图2)。
以上的研究结果引发研究者思考,定位于细胞膜中的Piezo通道是如何感知大脑内在细微机械力的刺激?肖百龙与李雪明课题组通过长期合作研究,最近针对Piezo1在脂膜上受力状态下的动态结构解析对这一问题给予了解答(Yang et al., Nature 2022)。机械门控Piezo1通道是同源三聚体,类似于一个巨大的三叶螺旋桨状结构,其在细胞膜上以弯曲和非平面形式存在。其中非平面形状的一个整体弯曲成开口直径20 nm和深度10 nm的标志性纳米碗状结构。根据力的感知机制和曲率形变特性:Piezo1通道从弯曲到平展状态,其桨叶高度位移为10 nm,所占平面膜面积增大300 nm2,需要做功为570 pN.nm,计算得出最大半激活膜张力值为1.9 pN/nm,这与电生理测量值1.4 pN/nm接近。细胞在静息状态下膜张力约为1–2 mN/m。Piezo1能够对各种形式的机械刺激作出反应,包括戳、拉伸、剪切力、基底硬度,以及内源性的细胞牵拉力。因此,Piezo1通道可以响应纳米尺度的曲率形变去探测皮牛尺度的力,成为一类低能耗的超敏机械力感受器。研究者提出分布在星形胶质细胞纳米尺度触手上的Piezo1,可以有效感知大脑机械微环境。
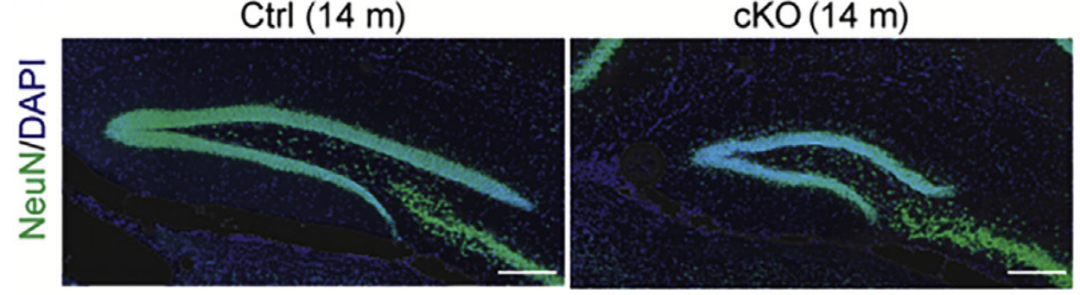
图1 星形胶质细胞Piezo敲除小鼠海马体积变
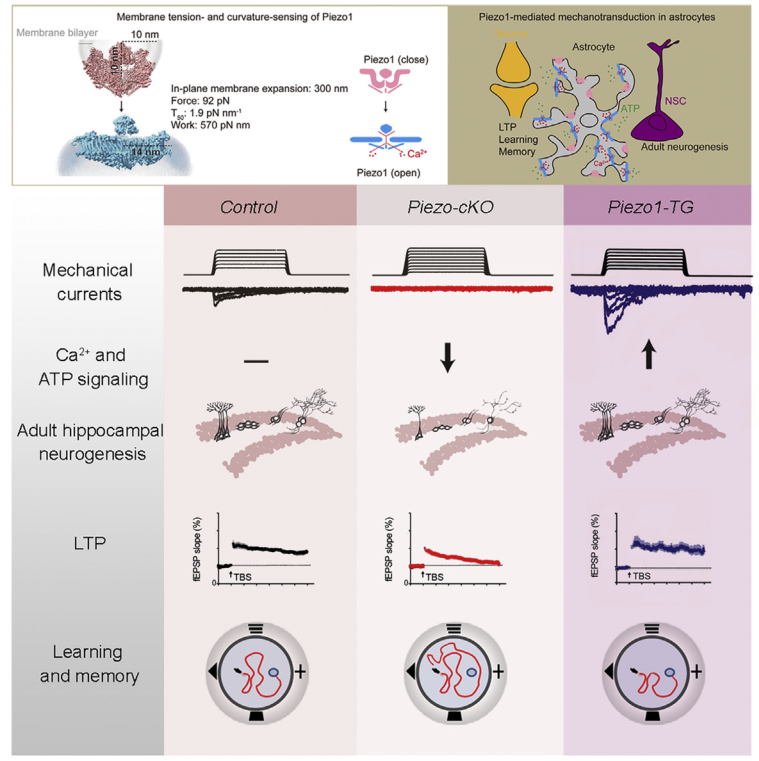
图2 星形胶质细胞Piezo介导机械信号转导调节大脑结构与功能的模式图。
综上,本文揭示了星形胶质细胞利用Piezo1通道介导的机械传导机制有效地调节海马成体神经发生和认知功能,从概念上强调了机械信号转导在维持大脑结构和功能中的重要性。
上述研究于2022年8月12日发表在《神经元》 (Neuron) 杂志上,标题为《Piezo1介导星形胶质细胞的机械信号传导并调节海马成体神经发生和认知功能》(Astrocytic Piezo1-mediated mechanotransduction determines adult neurogenesis and cognitive functions)。
肖百龙教授为本文的通讯作者,清华大学药学院2016级池少鹏博士、崔亚雄博士后、王海平博士后为本文的共同第一作者,2017级博士生姜京徽,2013级张廷鑫博士、清华大学生命学院钟毅教授、北京大学IDG麦戈文脑科学研究所周专教授和孙素华博士也参与了该项研究的部分工作。感谢北京大学生命科学学院李毓龙教授和武照伐博士在其所开发的ATP荧光探针方面所提供的帮助、清华大学药学院鲁白教授对提供了双光子仪器帮助、清华大学动物中心的常在博士和工作人员对该课题小鼠饲养提供的帮助、清华大学尼康影像中心在成像实验方面的帮助、肖百龙实验室已毕业学生王婧、王莉博士在课题开展过程中给予的帮助。
本工作得到了国家自然科学基金委杰出青年科学基金(31825014)/重点项目(32130049)/创新研究群体项目(32021002)、国家科技部2030科技创新-“脑科学与类脑研究”重大项目(2021ZD0203301)、清华-北大生命科学联合中心、膜生物学国家重点实验室、清华-IDG/麦戈文脑科学研究院、北京生物结构前沿研究中心、结构生物学高精尖创新中心的项目经费支持。
