近日,清华大学药学院杨悦课题组应邀在药学知名期刊《Drug Discovery Today》在线发表了题为《中国获得突破性疗法资格认定的药物评估:2020-2022年汇总分析》(Assessment of the breakthrough-therapy-designated drugs granted in China: a pooled analysis 2020–2022)的文章。
2020年7月国家药品监督管理局组织制定《突破性治疗药物审评工作程序(试行)》,以加快用于防治严重危及生命或严重影响生存质量疾病的药物研发,引起了行业广泛关注。该研究介绍了我国突破性治疗药物程序的特点,并对自该文件发布开始到2022年4月获批的78个获得突破性疗法资格认定(BTD)的新药(82个适应症)进行了评估。结果显示:国产新药获得突破性疗法资格认定主要集中在肿瘤领域。进口新药获得突破性疗法资格认定的时间明显快于国产新药。与非BTD药物相比,BTD药物可以显著缩短临床试验和审评时间。此外,近35%的BTD药物同样获得了美国FDA的突破性疗法资格认定,这表明企业可采用在中国和美国同时申请BTD的研发策略,加快新药在全球同步上市。BTD的实施有望进一步加快我国新药的研发,更好解决未满足的临床需求。
1. 我国BTD药物治疗领域主要集中在肿瘤领域
在82个获得BTD的药物适应症中,肿瘤领域占比过半(51/82),其次为抗感染药物。在抗肿瘤BTD药物中,最常见为用于治疗淋巴瘤(14/82)和肺癌(13/82)。相比于进口BTD药物,国产BTD药物更加聚焦于肿瘤领域(34% vs. 86%; P<0.001)其中,最常见的抗肿瘤靶点为PD1/PDL1(n=7),HER2(n=6)和P13K (n=6)(图-1)。
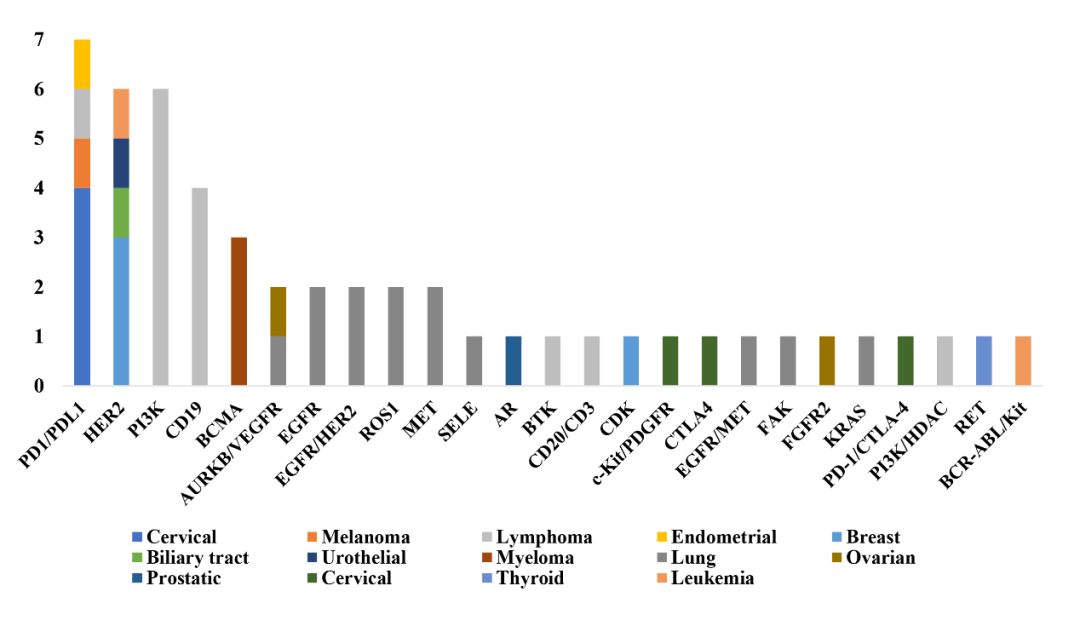
图-1 抗肿瘤BTD药物靶点分布 (n=51)
2. 进口新药获得BID时间显著短于国产新药
课题组对获得BTD药物的时间(从IND批准时间至BTD批准时间)进行了单因素影响分析,发现获得BTD时间与是否为国产或进口新药相关,而与给药途径(口服或非口服)、药物类型(小分子药物或生物制品)、药物分类(新药或改良新药)以及是否获得FDA的BTD无明显关系(图-2)。这可能与我国2018年开始接受境外临床试验数据有关。由于部分进口新药在进入我国开展临床试验之前,已在境外积累了一些临床试验数据,因此相比国产新药可能更快获得我国的突破性疗法资格认定。
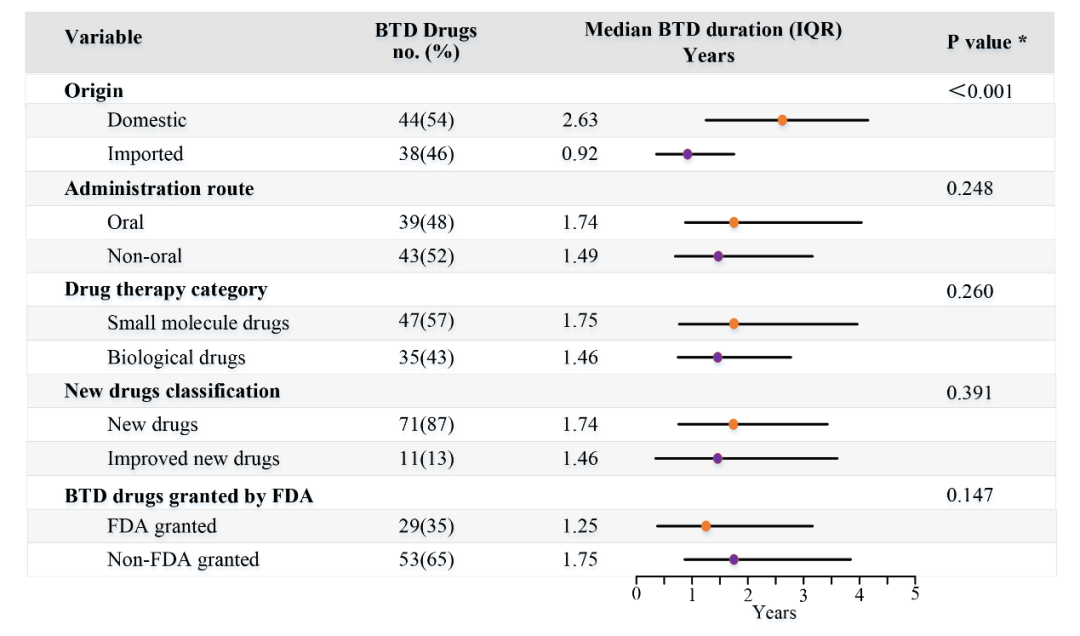
图-2 获得BTD药物时间的单因素影响分析
3. BTD新药有望缩短研发时间,加快新药上市
课题组以2021年批准的1类新药(非BTD药物)作为对照组,对比了BTD药物和非BTD药物在临床试验时间(定义:IND批准时间到NDA提交时间)以及审评时间方面(定义:NDA提交时间到NDA批准时间)的差异。结果显示BTD药物可显著缩短临床试验及审评时间(图-3)。由于纳入的BTD药物数量有限,该结论有待进一步验证。
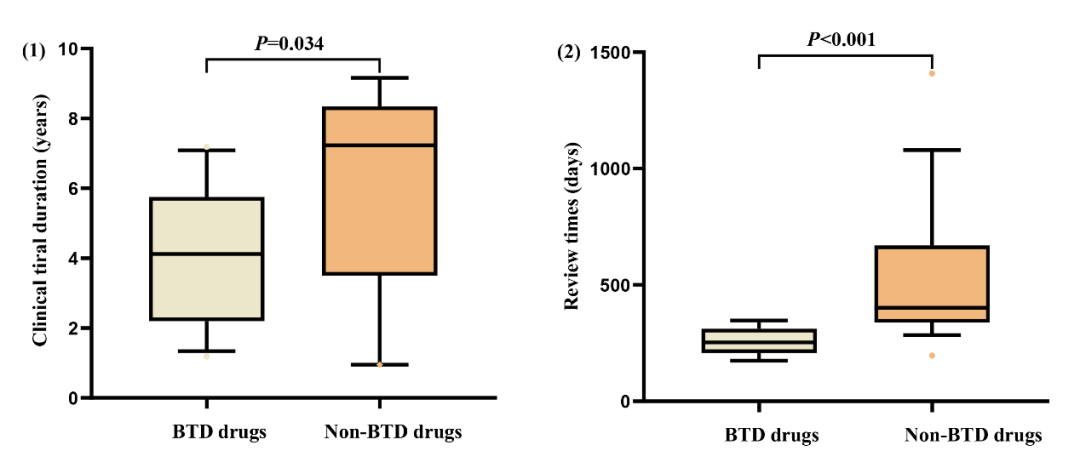
图-3 对比BTD药物和非BTD药物在临床试验时间和审评时间方面的差异
近年来,有不少国外研究发现BTD药物在有效性、安全性和创新性方面与非BTD药物并无明显差异[1][2],这也提示我国应当逐步完善BTD资格认定标准,包括加强对生物标志物和替代终点研究、建立临床价值评估框架等,以保证BTD药物有真正的“突破性”治疗效果,为患者带来更多的希望。
Reference
[1] Hwang TJ, Franklin JM, Chen CT, Lauffenburger JC, Gyawali B, Kesselheim AS et al. Efficacy, safety, and regulatory approval of Food and Drug Administration-designated breakthrough and nonbreakthrough cancer medicines. J Clin Oncol. 2018; 36:1805–1812.
[2] Mulder J, Pasmooij AMG, Stoyanova-Beninska VV, Schellens JHM. Breakthrough
therapy-designated oncology drugs: are they rightfully criticized? Drug Discov Today. 2020; 25:1580–1584.
本文第一作者为清华大学药学院博士后罗兴献,通讯作者为清华大学药学院杨悦研究员,感谢药学院钱锋院长课题组对该研究提供的帮助和支持。该项研究得到了清华-北京大学生命科学联合中心基金的项目经费支持。
