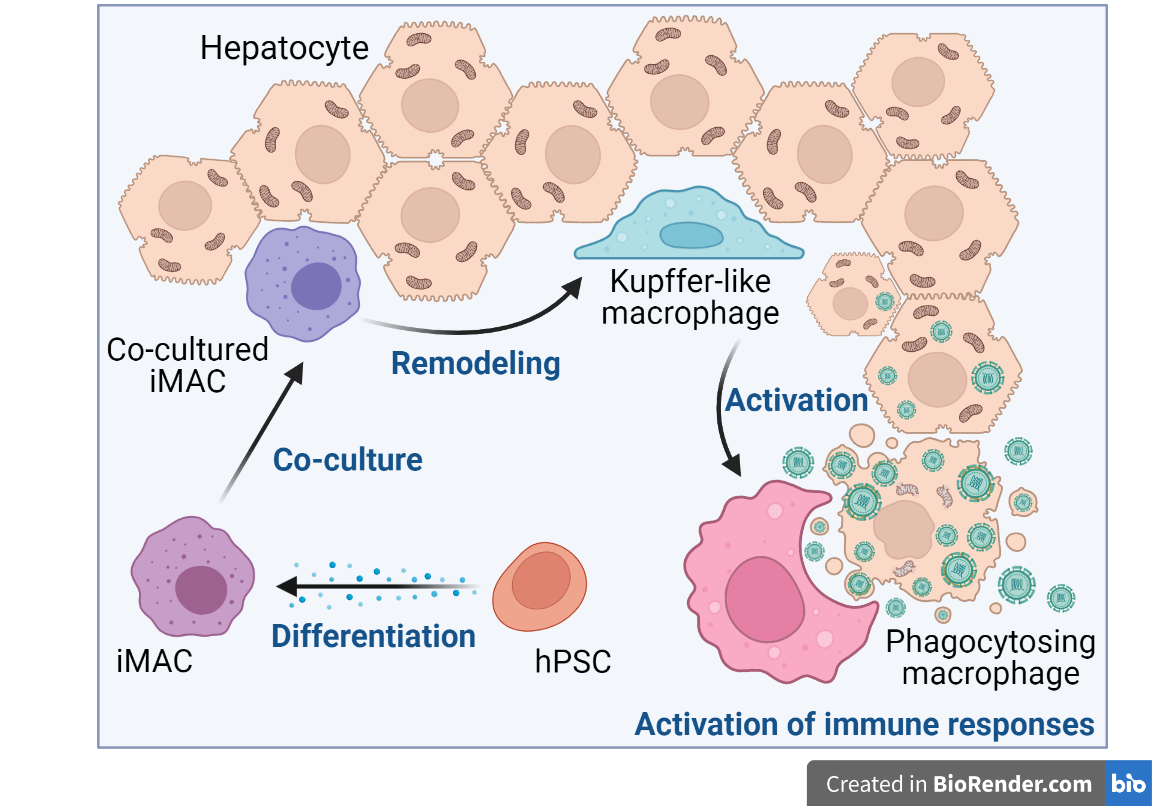
研究摘要图
肝炎病毒如乙肝病毒(HBV)和丙肝病毒(HCV)特异性感染人和少数高等灵长类动物的肝细胞。而作为肝脏驻留型巨噬细胞的Kupffer细胞(KC)在清除病原体的过程中发挥着重要的作用。但由于人类KC来源十分有限,研究KC在肝炎病毒感染过程中的作用和调控机制收到了较大的限制。因此,人多能干细胞(human pluripotent stem cell, hPSC)分化的巨噬细胞(induced macrophage, iMAC)可作为替代人组织驻留型巨噬细胞如KC的细胞来源。
2024年2月24日,清华大学基础完美体育·(中国)官方网站那洁组和丁强组合作在Life Medicine(生命 医学)杂志在线发表了题为Modeling antiviral response in the liver using human pluripotent stem cell-derived macrophages(应用人多能干细胞来源的巨噬细胞模拟肝脏中的抗病毒反应)的研究论文,应用人多能干细胞衍生的巨噬细胞模拟肝脏微环境中KC对肝炎病毒感染的反应。
研究者首先建立了从hPSC分化iMAC的体系,能够在两周时间内经过CD34+ CD43+的造血干/祖细胞(HSPC)中间状态,得到CD45+ CD14+ CD68+ CD163+的iMAC(图1 A-C)。对分化体系进行单细胞转录组测序(scRNA-seq)和单细胞染色质开放性(scATAC-seq)分析发现,绝大多数(70%)分化细胞为单核-巨噬细胞谱系,它们在UMAP图上形成了一个连续类群(图1D),高表达相应谱系标志基因CSF1R、MAF、MRC1等(图1F),其染色质区域也更为开放(图1G), RNA速率分析显示单核-巨噬谱系形成一个连续的时序轨迹(图1H)。
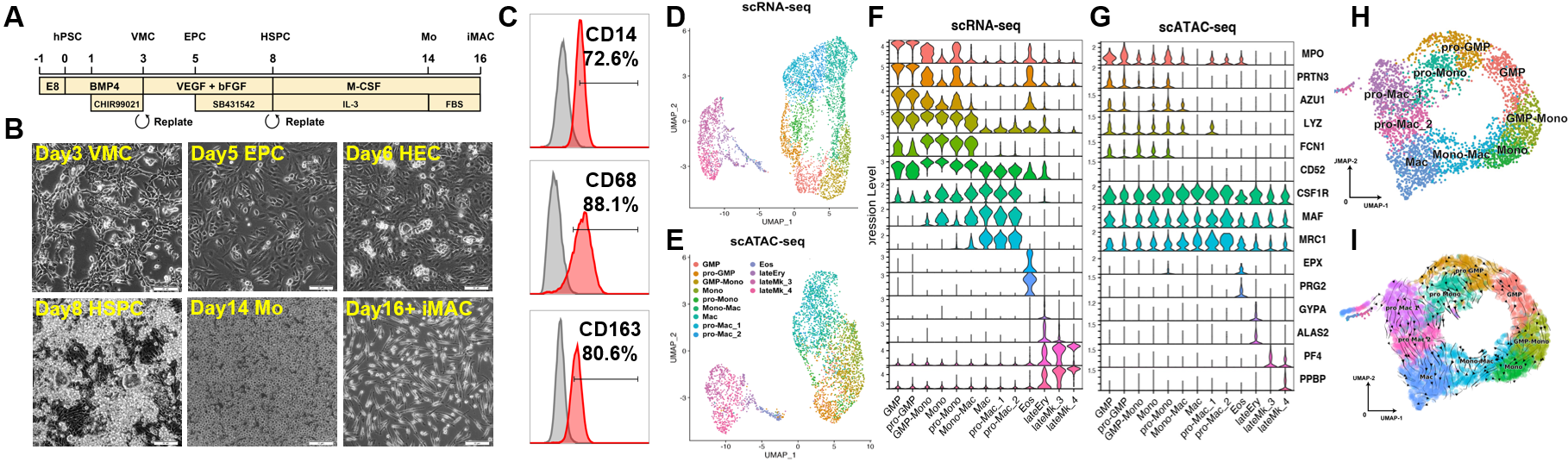
图1. hPSC分化iMAC体系的鉴定和单细胞多组学分析
为促进人巨噬细胞向KC转变,研究者又建立了iMAC与肝脏细胞的共培养体系。免疫荧光染色展示iMAC在与人原代肝细胞(pHH)或人肝癌细胞Huh7共培养后均表现出类似KC的延长、伸展形态,并高表达CD163。转录组测序也表明共培养后的iMAC与人体内原代的KC更为相似。接着,研究者发现在共培养体系中,iMAC能显著抑制HCV感染Huh7细胞,减少感染体系上清中的HCV浓度,即抑制HCV的释放。研究者进而探究了iMAC是否能够缓解或治愈已感染HCV的Huh7,发现iMAC能通过吞噬已感染HCV的Huh7显著大幅减少受感染的Huh7比例,并降低Huh7细胞中的HCV载量。另外,上述抗病毒作用需要iMAC与Huh7直接接触,并依赖iMAC的数量。
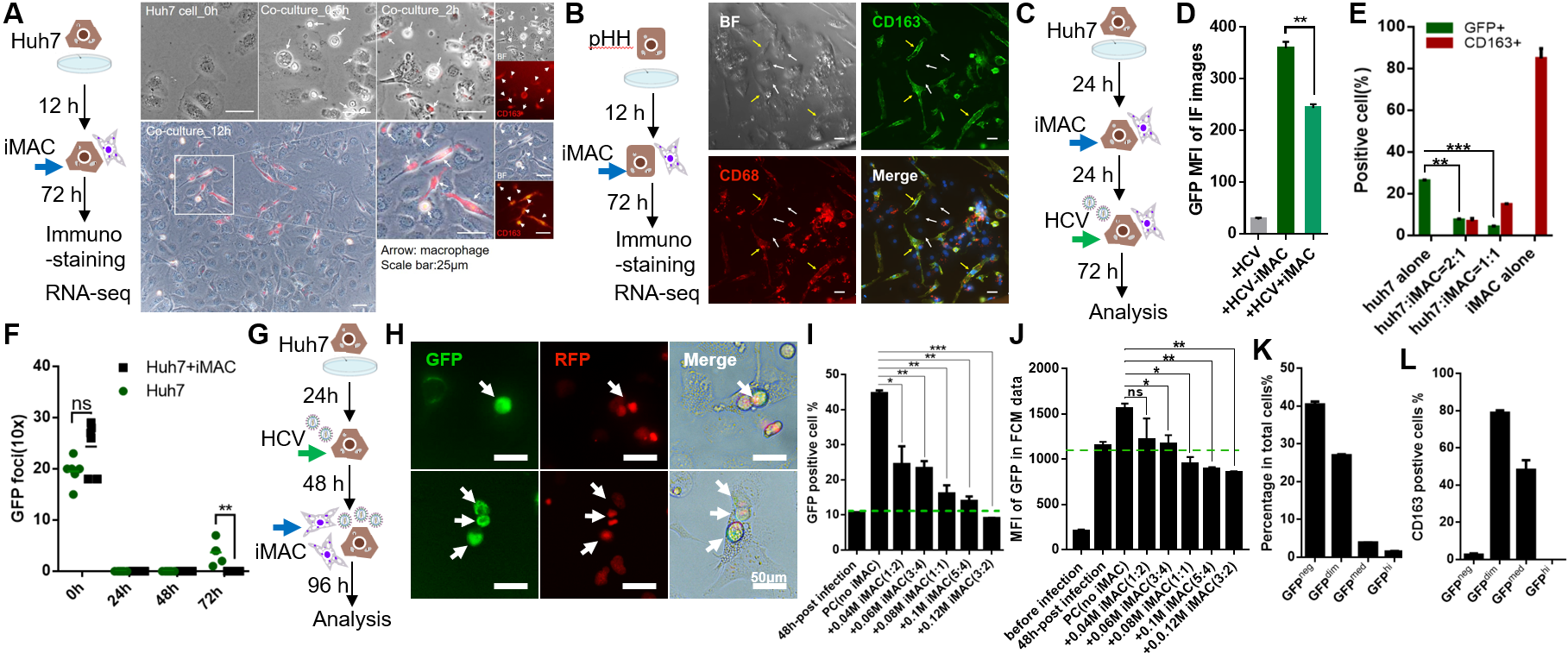
图2. iMAC在与肝细胞共培养体系中的抗HCV作用研究
综上,研究者利用hPSC分化得到了iMAC并对其在单细胞水平上进行了验证。与人肝脏细胞共培养后,iMAC适应了组织微环境并特化为KC样细胞,同时表现出相应的基因表达变化。这种KC样iMAC在共培养中对HCV有很强的抑制作用,这取决于iMAC与感染的宿主细胞的直接接触。研究者的研究结果表明,hPSC来源的iMAC能够为研究肝脏感染过程中的免疫过程提供有效的模型。
清华大学基础完美体育·(中国)官方网站那洁副教授和丁强副教授为本文共同通讯作者,清华大学基础完美体育·(中国)官方网站博士研究生张雅瑄、医学实验班张兴武、已毕业博士段福宇、基础完美体育·(中国)官方网站博士研究生乔慧敏、龚明丽为共同第一作者,生命学院博士研究生邱辉、基础完美体育·(中国)官方网站陈霞博士、博士研究生王佩亮,以及清华大学-勃林格殷格翰感染疾病免疫治疗联合研究中心的何源博士对本研究做出了重要贡献。
本研究得到国家干细胞及转化研究重点专项、国家自然科学基金委项目、清华大学-勃林格殷格翰感染疾病免疫治疗联合研究中心和清华大学春风基金的支持。
原文链接:https://doi.org/10.1093/lifemedi/lnae001
供稿人: 那洁
审稿人: 程功
提交人: 谭晓萍
