2022年10月19日,清华大学药学院刘刚课题组在美国化学会药物化学杂志《Journal of Medicinal Chemistry》在线发表题为“Identification of 1,4-Benzodiazepine-2,5-dione Derivatives as Potential Protein Synthesis Inhibitors with Highly Potent Anticancer Activity”的研究工作,报道了一类基于1,4-苯并二氮杂卓-2,5-二酮优势骨架的化合物,可抑制细胞内蛋白质合成诱导癌细胞凋亡,属首次发现该类骨架化合物作为蛋白质合成抑制剂用于癌症治疗的潜在用途。
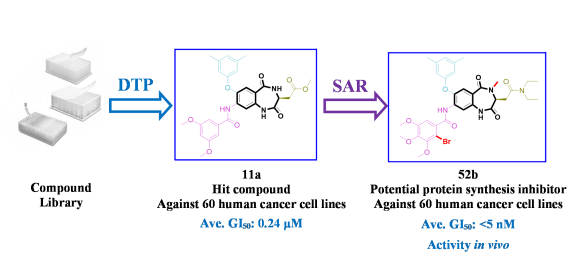
图1:基于表型筛选化合物库确定了苗头化合物11a,SAR研究得到化合物52b
癌症是威胁人类健康的重大疾病之一。2020年世界癌症报告显示,2018年全球新发癌症病例达1810万例, 死亡960万例,而肺癌居于癌症新发病例数和死亡病例之首。虽然目前临床治疗肺癌的手段丰富,但是耐药和复发、转移等问题依然是困扰肺癌患者的重要问题。
刘刚教授团队通过与美国国家癌症中心(National Cancer Institute)的长期合作,对课题组内的“优势骨架导向性”化合物库进行基于抑制癌细胞生长表型的活性筛选,发现了两类具有抗肿瘤活性的化合物,一类为苯并噻唑类衍生物(Eur. J. Med. Chem. 2014, 76, 67–78.),另一类为1,4-苯并二氮杂卓-2,5-二酮衍生物。
进一步对1,4-苯并二氮杂卓-2,5-二酮苗头化合物11a深入的“构-效”关系研究,发现了具有广谱抗癌活性的化合物52b,其对9类60株人癌细胞的平均50%生长抑制浓度(GI50)小于5nM,具体“构-效”关系总结如下(图2)。
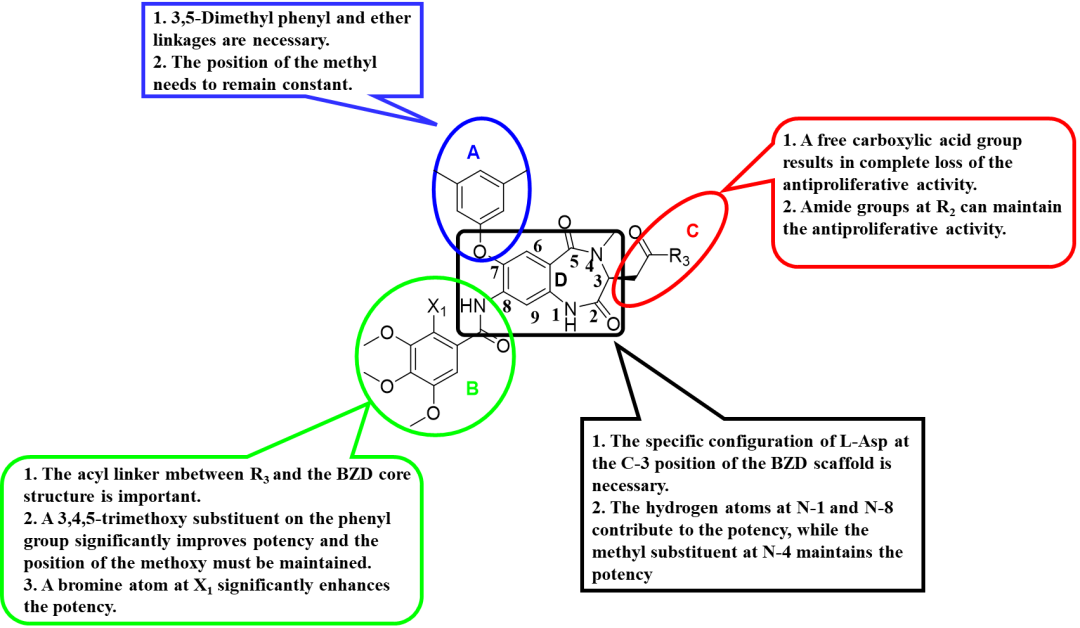
图2:1,4-苯并二氮杂卓-2,5-二酮类化合物的抗肿瘤活性“构-效”关系
机制研究表明,化合物52b可将肿瘤细胞生长阻滞在G1/S期,并诱导细胞凋亡家族蛋白活化。通过NCI correlation coefficients (COMPARE analysis) 分析(表1)及相应的实验研究,排除了化合物作为微管蛋白抑制剂、拓扑异构酶抑制剂、以及激酶抑制剂的可能性。
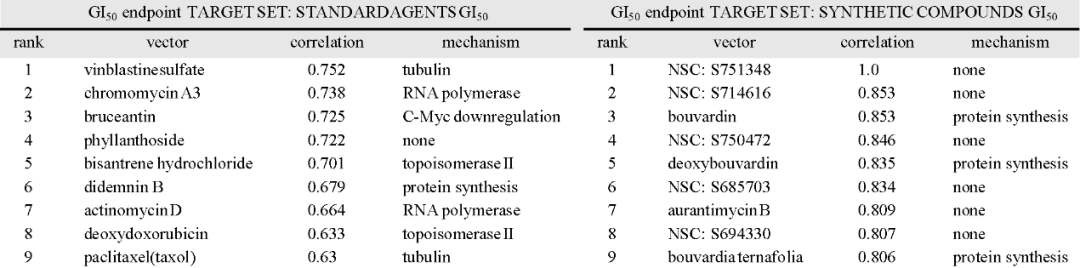
表1:COMPARE分析预测化合物潜在作用机制
进一步研究发现,化合物52b可有效抑制癌基因c-Myc的蛋白表达,但并不影响c-Myc的转录。Polysome profile分析表明该化合物通过阻止多聚核糖体的形成,抑制细胞内蛋白质的合成(图3)。体内实验表明该化合物可有效抑制NCI-H522肺癌裸鼠移植瘤模型的肿瘤生长。
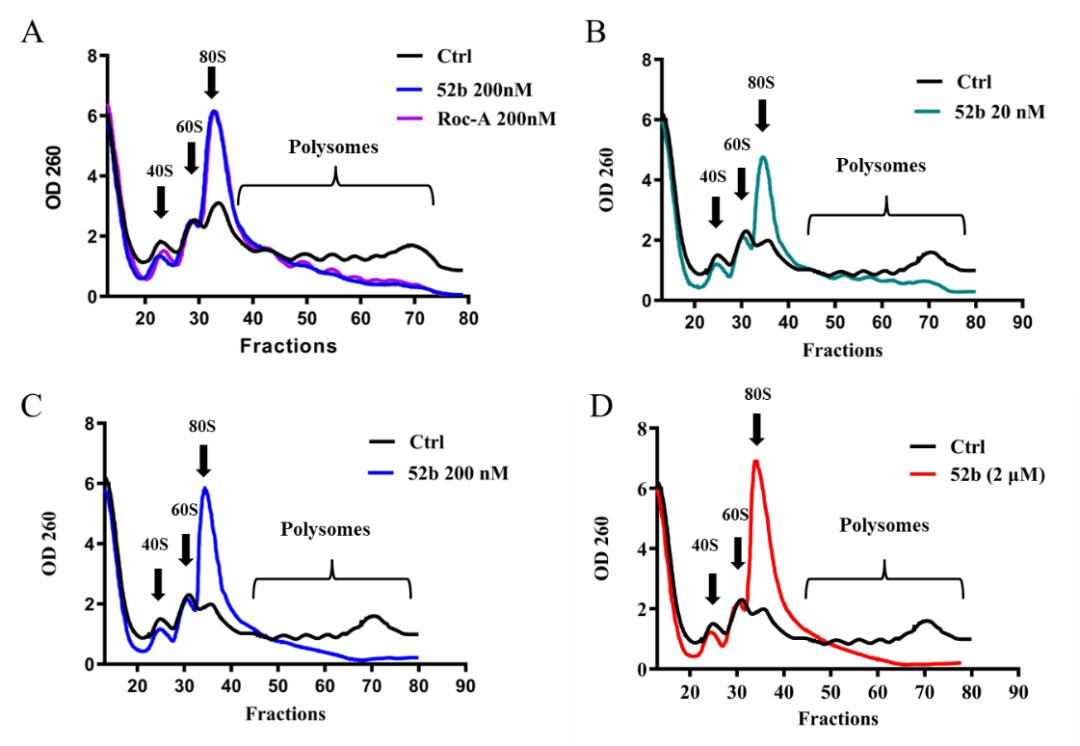
图3:Polysome profile分析显示化合物52b抑制多聚核糖体的形成
综上所述,该研究通过构建“优势骨架导向性”化合物库,结合基于表型的大规模活性筛选及药物化学优化手段,发现了具有超高抗肿瘤活性的化合物52b,该化合物通过抑制多聚核糖体的形成,抑制肿瘤相关蛋白的表达,进而诱导肿瘤细胞凋亡。
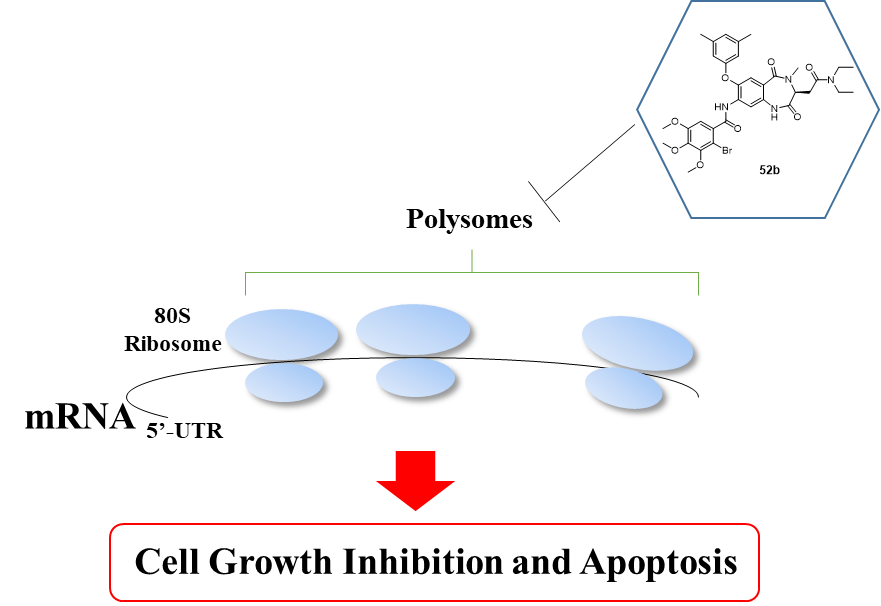
图4:化合物52b的抗癌活性作用机制假想图
清华大学药学院刘刚教授及中国医学科学院药物研究所董毅副研究员为本文的通讯作者。刘刚课题组于文俊博士、解希雷博士及马瑶博士为本论文的共同第一作者。本项研究得到了国家自然科学基金委以及清华-佛山创新专项基金的支持和帮助。
原文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.2c01431
