2021年8月20日,清华大学药学院饶燏团队在《Cell Research》杂志上发表了题为“Merging PROTAC and molecular glue for degrading BTK and GSPT1 proteins concurrently”的研究论文,该工作报道了一类新型的双机制降解剂,该降解剂既能够以PROTAC方式靶向BTK,同时也以分子胶的方式降解GSPT1,与单靶降解剂或抑制剂相比,这种双机制降解剂实现了更高效的DLBCL和AML肿瘤细胞增殖抑制效果,为DLBCL和AML治疗提供新型治疗方案。

靶向蛋白降解是以泛素-蛋白酶体系统为基础,用小分子降解剂诱导靶蛋白降解的一种技术,其中最主要的两种降解机制包括PROTAC和分子胶。PROTAC分子由三部分组成,此种组装方式形成的嵌合体可将靶蛋白锚定到E3泛素连接酶进而诱导其泛素化降解。与PROTAC类似,分子胶是单一的小分子片段,分子量较小,它通过诱导靶蛋白与E3泛素连接酶之间形成较为紧密的蛋白-蛋白相互作用来实现泛素化降解。
近几年两种蛋白降解技术发展迅速,但也显露出各自的优缺点,例如PROTAC适于理性设计,但由于分子量偏大,导致成药性不足。分子胶分子量小,成药性好,且能降解难成药靶点,可以弥补PROTAC的不足,但由于需要在两个蛋白之间诱导形成一个结合口袋,设计上具有非常大的难度。而如何平衡二者的优劣之处使靶向降解技术得到进一步发展是一个非常值得思考的问题,为打破现有技术的桎梏,作者在此工作中首次提出了将PROTAC分子与分子胶相融合的概念,为靶向蛋白降解开拓了一条新的道路。
作者在之前的工作中实现了BTK野生型和突变型蛋白的高效降解,解决了临床耐药问题,但另一挑战出现了,目前不论是BTK抑制剂还是PROTAC分子,对难治性的DLBCL及AML很难达到较好的治疗效果,而为了突破这一难题,作者想到可利用另一靶点的同时降解来实现,GSPT1是翻译终止因子,协调完成体内蛋白的翻译过程,而GSPT1的下调可使蛋白表达异常,进而抑制多种肿瘤细胞的增殖和生存。因此作者希望利用双机制降解剂将GSPT1的降解引入到靶向BTK的PROTAC分子中,进而打破靶向BTK分子在淋巴瘤应用中的壁垒。
如何将PROTAC与molecular glue两种降解机制相融合是这篇工作中作者要解决的核心技术问题。因此基于此前开发的靶向BTK的PROTACs及已有针对GSPT1的分子胶的研究,作者开发了一系列双靶双机制降解剂并证明了这类降解剂分别以PROTAC和分子胶的方式降解BTK和GSPT1,首次实现了PROTAC和分子胶的理性结合和设计。并且与单靶抑制剂ibrutinib或降解剂L18I相比,作者所提出的双机制降解剂在多种DLBCL及AML细胞上均具有更高效的增殖抑制活性,为临床治疗提供了新的方案,这也是该工作开发新型降解剂的应用价值所在。
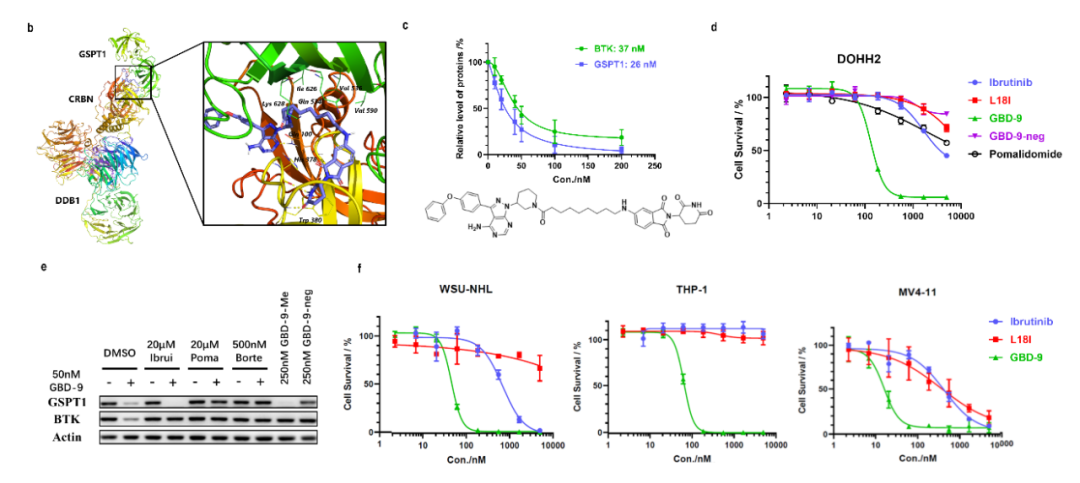
综上,作者根据PROTAC和分子胶的特点首次设计合成了一系列双靶、双机制的降解剂,这类新型降解剂既保留了降解BTK的PROTAC活性,又兼具降解GSPT1的分子胶特点,以PROTAC的思路设计合成双机制降解剂解决了分子胶设计难度高的问题,而作为分子胶降解GSPT1也补充了PROTAC在生物活性上的不足,对难治性肿瘤的临床治疗具有重要意义。因此,作者所致力于的双机制降解剂开发为靶向降解技术的发展打开了新的大门。
饶燏团队长期从事蛋白质靶向降解技术的开发工作,致力于发展新型降解技术及其应用,已取得了系列研究成果:实现难成药靶点的药物开发,设计合成全球首例选择性CDK2降解剂,实现AML高效且低毒的分化治疗(Nature Chemical Biology 2021);构建高效的BTK降解剂,解决临床中出现的Ibrutinib耐药问题(Cell Research 2018;Leukemia 2019);构建PROTACs系统性敲除模型,快速可逆实现动物体内蛋白敲除(Cell Discovery 2019);构建PARP1降解剂(Chemical Communications 2019);构建新型CDK4/6降解剂,有效抑制肿瘤增殖(Journal of Medicinal Chemistry 2019);构建HDAC6降解剂,实现普适性的HDAC6的选择性降解(Protein & Cell 2019;Chemical Communications 2019);构建FAK高效降解剂,抑制肿瘤的快速迁移(ACS Medicinal Chemistry Letters 2019)。此次研究也是该团队拓展新型靶向蛋白降解技术研究的进一步延伸。
清华大学博士生杨子默、博士后孙永汇为该工作共同第一作者,清华大学饶燏教授为通讯作者。该研究得到了清华大学吴畏教授、邓海腾教授、李海涛教授、刘万里教授的大力帮助。该研究得到了国家自然科学基金、国家重大科技专项“重大新药开发”和国家重点研发计划的大力支持。
原文链接:https://www.nature.com/articles/s41422-021-00533-6
