2019年3月19日,清华大学药学院张永辉课题组在《Immunity》杂志上在线发表了题为“膦抗原通过结合乳糜蛋白诱导结构变化激活Vγ9Vδ2 T细胞” (A structural change in butyrophilin upon phosphoantigen binding underlies phosphoantigen-mediated Vγ9Vδ2 T cell activation) 的研究论文,报道了γδ T细胞的抗原识别机制,揭示了免疫治疗的新靶点。这是继2018年底该课题组在《Cell》杂志 上发表关于“甲羟戊酸通路是疫苗佐剂靶点”工作后,在免疫治疗领域的又一最新进展。同时,这两项工作也代表了张永辉课题组在脂化学生物学,尤其是类异戊二烯代谢领域的最新研究成果。
自然界是丰富多彩的,其生物合成的多样性与两个类异戊二烯焦磷酸小分子IPP、DMAPP息息相关(图1)。这两个小分子衍生出自然界分布最广的天然产物,即类异戊二烯化合物,它们存在于植物、细胞、寄生虫及细菌等几乎每一种生命形式中,包括青蒿素、紫杉醇、胆固醇以及辅酶Q10等众多分子。探索类异戊二烯化合物的功能、调控对象及其生理学意义曾长期是上世纪科学领域所关注的前沿课题。
在真核细胞中,DMAPP和IPP最终生成了胆固醇,同时也产生了下游长碳链的类异戊二烯焦磷酸例如GGPP等(图1)。上个世纪科学家们(Konrad Emil Bloch, Joseph Goldstein、Michael Brown等)关注于胆固醇的生物合成及其负调控机制,这些杰出的工作帮助人类深入地了解了生命体的奥秘,并促进了他汀这一历史销售量最大的小分子药物的诞生。相比较而言,科学家对GGPP的关注相对较少。2018年11月,张永辉课题组曾在《Cell》杂志 上发表文章,报道树突状细胞中GGPP的含量可以影响小G蛋白(例如Rab5)的脂化修饰,影响了内体运输、MHC-多肽抗原复合物的丰度,以及最终对CD4和CD8 T细胞的活化。根据T细胞受体链组成的不同,CD4和CD8 T细胞被划分为αβ T细胞。αβ T细胞能通过其表面受体TCR特异性识别靶细胞表面MHC分子呈递的“非我”或肿瘤新生多肽抗原,这是现代免疫治疗的核心理论之一。
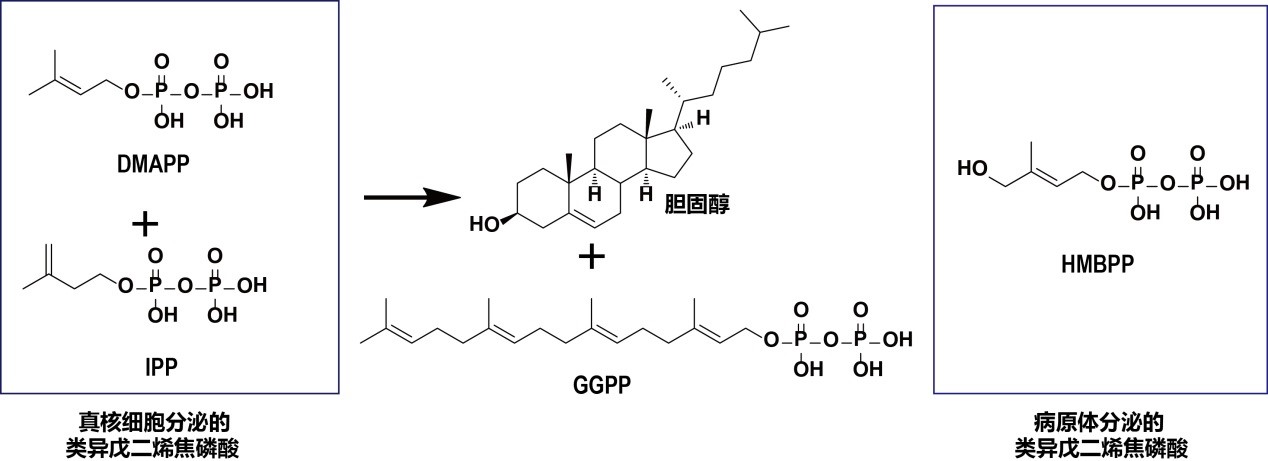
图1:各种类异戊二烯焦磷酸的化学结构,其中DMAPP, IPP是合成胆固醇及GGPP的起始底物,而GGPP可以调控αβ T细胞对抗原的识别;HMBPP则是目前γδ T细胞刺激活性最强的膦抗原。
而根据TCR链的不同,还有一类T细胞叫做γδ T细胞。人外周血中主要的γδ T细胞亚群是Vγ9Vδ2 T细胞。与αβ T细胞不同的是,这类γδ T细胞并不识别多肽抗原,但能有效地杀灭肿瘤和病原体。这是因为肿瘤细胞中胆固醇代谢通路异常会使其累积大量的DMAPP、IPP;同时,病原体包括革兰氏阴性菌和疟原虫能产生另外一种类异戊二烯焦磷酸HMBPP。DAMPP、IPP和HMBPP能激活γδ T细胞,这些类异戊二烯焦磷酸化合物被称为“膦抗原”。其中,HMBPP比DAMPP、IPP在化学结构上多一个羟基(图1),但活性却强于后者近千倍。
γδ T细胞识别这些膦抗原并不受MHC分子的限制。该领域的前期研究表明乳糜蛋白3A1(BTN3A1)是膦抗原的递呈分子。BTN3A1是一次跨膜蛋白,属于B7相关的分子。膦抗原是如何通过BTN3A1激活γδ T细胞的呢?这是T细胞领域长期一直未能回答的问题。
在过去4年中,张永辉团队系统地研究了γδ T细胞对膦抗原HMBPP的识别模式(图2)。他们通过晶体结构研究发现HMBPP结合在BTN3A1的胞内段,其中HMBPP的焦磷酸头部与蛋白的6个碱性氨基酸存在氢键或盐桥的结合,而其独特的羟基则与BTN3A1胞内段氨基酸H351、Y352形成了2个氢键。这种氢键结合在内源性抗原DMAPP, IPP上是观察不到的。这就从结构生物学上解释了病原体产生的HMBPP为什么比内源的DMAPP、IPP能更好地激活γδ T细胞。该团队继而通过化学生物学手段、尤其是小分子探针的策略,发现BTN3A1的单体本身并不足以将HMBPP的结合信号传导给γδ T细胞,并推断BTN3A1胞内段可能是以不对称二聚体的模式将HMBPP结合引起的构象变化传递到细胞外。而后续的突变、晶体结构、免疫功能及分子动力学等一系列研究则表明,HMBPP的羟基帮助引发了胞内段氨基酸H351及周围区域构象的变化,而不对称的二聚体能帮助这种变化更有效地通过跨膜区传到细胞外。最后,该团队借助于单细胞原子力显微镜等生物物理手段,发现这种胞外段的构象变化引起了BTN3A1胞外段与γδ T细胞受体结合能力的加倍,从而促进了对γδ T细胞的激活。
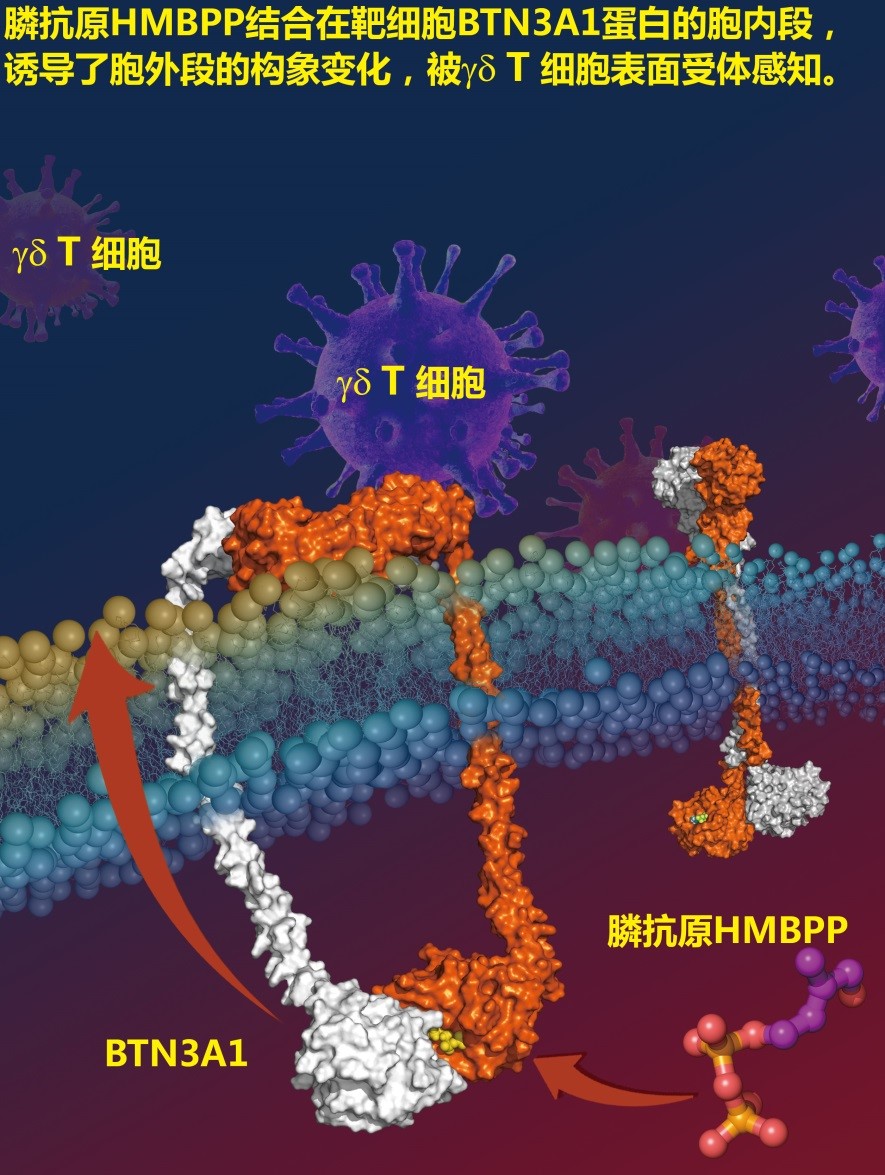
图2:本研究总结的γδ T细胞对膦抗原HMBPP的识别模式
BTN3A1采取这种罕见的“由内而外”的信号传导模式帮助膦抗原激活了γδ T细胞,这与目前免疫学中传统的T细胞抗原识别模式截然不同。在传统的3种T细胞抗原识别模式中(图3 - I,II,III),抗原都是结合在抗原递呈分子例如MHC的胞外段,从而实现与T细胞受体更有效的结合。因此,该研究帮助完善了T细胞抗原识别的第四种模型(图3 - IV)。
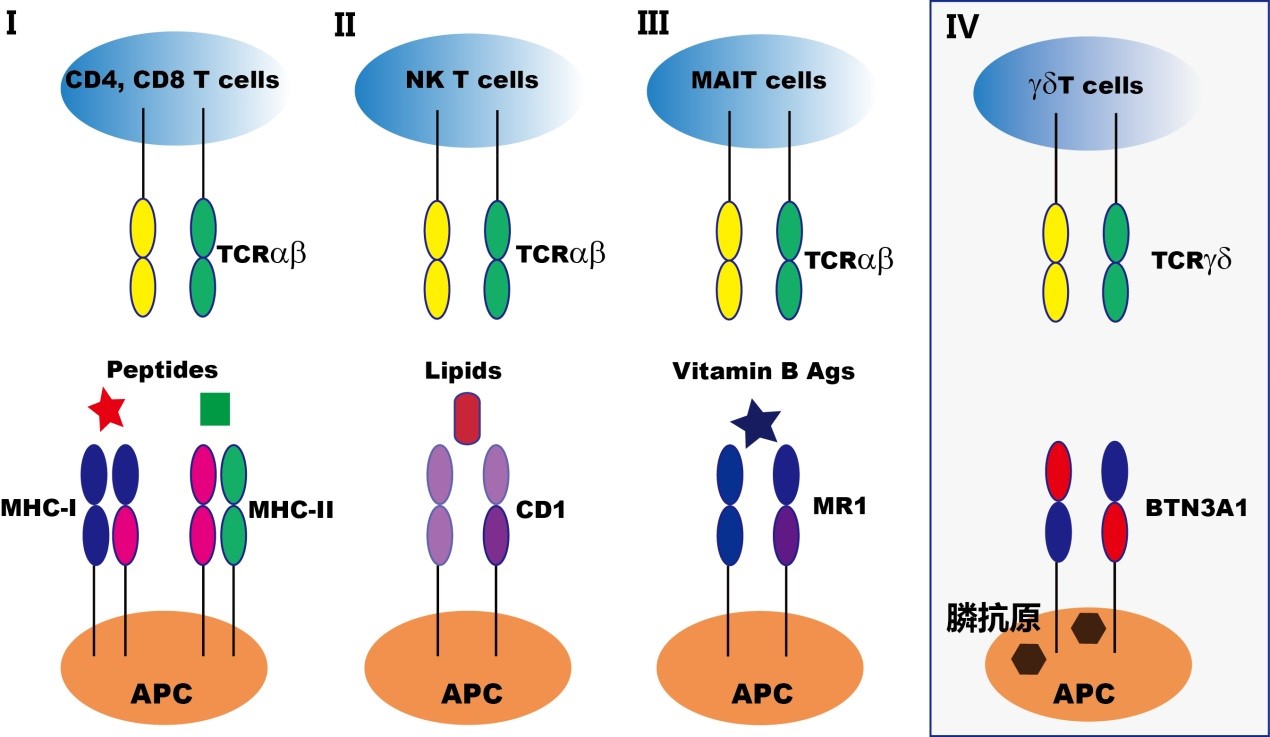
图3:T细胞抗原识别模式,前三种都属于αβ T细胞。第四种为γδ T细胞。
该工作于2019年3月19日在线发表在《Immunity》杂志上,它揭示了低碳数的类异戊二烯焦磷酸是如何激活γδ T细胞。而该小组于2018年发表在《Cell》杂志上的工作,发现了高碳数的类异戊二烯焦磷酸GGPP是如何调节αβ T细胞对抗原的识别。张永辉团队这两项研究,从整体上揭示了类异戊二烯焦磷酸这一类特殊的脂类分子对T细胞应答的精妙调控。
需要指出的是,当前免疫治疗虽然取得了重大的突破,但以αβ T细胞为主的CAR-T细胞疗法对实体瘤尚未取得突破,而且很难实现异体的细胞治疗,这极大地限制了其应用空间。而γδ T细胞可用于异体治疗的特质及其在实体瘤乃至一些传染性疾病治疗中的潜力促使国际医药企业在该领域纷纷布局。理解γδ T细胞对肿瘤及病原体的识别机制将有助于发展更好的细胞治疗方案。此外,该领域长期缺乏高质量的小分子帮助γδ T细胞的有效扩增,以及对肿瘤细胞的高效识别。张永辉研究团队关于BTN3A1蛋白的深入研究,为发展基于γδ T细胞治疗的小分子药物提供了非常有效的靶点。
清华大学药学院张永辉研究员是本文的核心通讯作者。此外,湖北大学生科院、省部共建生物催化与酶工程国家重点实验室的郭瑞庭教授参与了研究讨论、晶体数据的分析;美国伊利诺伊大学Eric Oldfield教授参与了研究的讨论及论文撰写,为文章的共同通讯作者。张永辉课题组博士生杨云云、李丽平、袁琳洁及周晓英为论文的共同第一作者。清华大学免疫研究所石彦、刘万里小组也参与了部分研究。该研究得到了自然科学基金委、科技部重点研发计划、北京结构生物学高精尖创新中心、生命科学联合中心、清华大学蛋白质研究技术中心、清华大学药学技术中心的支持和帮助。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(19)30083-4
