2019年3月27日,清华大学药学院刘刚教授课题组及其合作者在《ACS Infectious Diseases》杂志上在线发表了题为“基于新型硝基还原酶Rv2466c的结核分枝杆菌诊断和药敏实验的荧光探针” (A Nitrooxidoreductase Rv2466c-dependent Fluorescent Probe for Rapid Mycobacterium Tuberculosis Diagnosis and Drug Susceptibility Testing) 的研究论文,报道了NFCs作为小分子荧光探针用于结核病诊疗的新发现。这是该课题组通过合作研究于2014年在《Journal of Medicinal Chemistry》杂志上发表关于“NFCs可以选择性地高活性抑制复制型以及非复制型结核分枝杆菌”(doi: 10.1021/jm4019228.)以及2018年初在《ACS Infectious Diseases》杂志上发表关于“Rv2466c是结核分枝杆菌内Mycothiol(MSH)依赖的硝基还原酶”(doi: 10.1021/acsinfecdis.7b00111)的研究结果后,在结核病诊疗领域的又一研究进展。
在全球范围内,结核杆菌(Mycobacterium tuberculosis,
Mtb)引起的结核病(Tuberculosis, TB)是具有高致死率的传染病之一。据WHO估计,仅2017年全球范围内:157万人死于结核病,新发现640万结核病案例;在新发现案例中有4.6%为多药耐药型结核杆菌 (MDR-TB) 感染,累积有105个国家发现有广泛耐药型结核杆菌(XDR-TB) 感染的病例;世界上近1/3的人口感染了潜伏性结核分枝杆菌。治疗周期长,副作用大,对MDR-TB及XDR-TB不敏感是目前化学治疗结核病亟待解决的问题。但是,在过去的40多年里仅有一个新结构类型的抗结核药物上市。除此之外,结核病的诊断方法,特别是快速诊断、耐药诊断也长期处于缓慢的发展状态。
2014年刘刚课题组与合作伙伴首次报道基于 (+)-Calanolide A改造的硝基呋喃香豆素类结构(nitrofuran-coumarins,NFCs)是一种针对活动性结核和潜伏性结核分枝杆菌的高效抑制剂。(+)-Calanolide A是从马来西亚热带雨林植物藤黄科胡桐属植物长茎胡桐(Calophyllum lanigerum)中分离得到的具有抗HIV-1和抗Mtb活性的天然香豆素衍生物。在Gates基金资助下,刘刚教授团队及其合作者通过筛选十余万个化合物发现Calanolide衍生物具有较好的抗活动性结核和潜伏性结核双重活性,并进一步细致研究了Calanolide 的构效关系,优化出硝基呋喃香豆素类衍生物NFCs,对活动性结核和潜伏性结核的抑制活性均可达0.08 μg/mL(图1)。此外,相对于其他常见的革兰氏阳性菌和阴性菌,NFCs 展示出对
Mtb的选择性抑制作用以及对感染人巨噬细胞的
Mtb 的高活性(图2)。
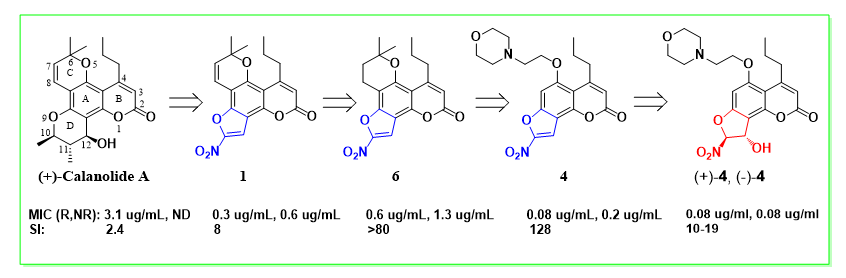
图1 天然(+)-Calanolide A及其类似物的抗结核活性研究
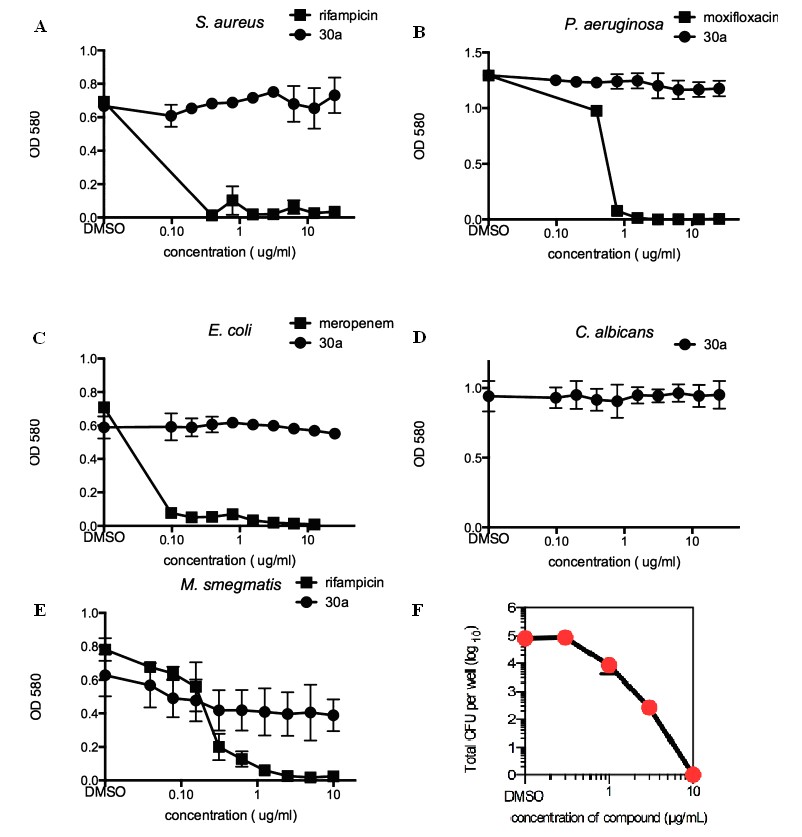
图2 NFCs可选择性抑制
Mtb并感染人巨噬细胞的
Mtb
该类化合物具有遗传毒性导致无法继续开发新药,但其新颖的作用机制引起了研究团队的兴趣。通过遗传学,结构生物学,计算化学,生物化学和生物物理学等手段及方法揭示了与NFCs活性相关的酶—Rv2466c,为一类新型的氧化应激硝基还原酶。该酶需在小分子硫醇mycothiol(MSH)辅助下,将NFCs的硝基还原为氨基(图3),并产生抑菌作用。Rv2466c、MSH、NFCs三者存在怎样的相互作用以及酶具体的还原机制是什么?该研究在结核病的诊疗过程中是否存在临床应用意义?刘刚教授团队为此进行了进一步研究。实验结果可以推测,Mtb分泌的小分子硫醇MSH通过其乙酰基半胱氨酸取代的葡萄糖胺部分(acetylated cysteine-glucosamine,AcCys-GlcN)结合Rv2466c,随后其巯基与与蛋白Cys 19形成二硫键(mycothiolation)后,调节蛋白形成活性构象,从而允许NFCs的进入,并与蛋白的W21,N51和Y61的相互作用形成Rv2466c/MSH/NFCs(RvMN)三元复合物;随后,Rv2466c还原NFCs的硝基为氨基(图3),这个过程伴随着荧光的释放,可用于
Mtb的快速诊断及药敏实验。随后的临床转化实验证明:(1)NFC荧光检测技术用于临床痰样本的诊断,与对照方法MGIT 960相比具有较高的一致性(曲线下面积:0.956,敏感性:87.8%,特异性:99.0%,阈值:1.559;(2)NFC荧光检测技术用于Mtb临床分离菌株的药敏实验,与临床微孔板药敏检测法及微孔阿尔玛蓝检测法(microplate-based alamarBlue assay,MABA)对比一致性高;(3)NFC荧光检测技术可直接用于临床随机痰样本的药敏试验,可给出准确的MIC值。
综上,NFC技术是一种基于结核分枝杆菌内硝基氧化还原酶Rv2466c的荧光诊断探针分子,具有机制新颖、操作简便、成本低廉、高通量以及可获得准确MIC值等优点,有望成为一种新型、简便、经济、准确的结核病诊断以及耐药结核病筛选方法,有利于结核的个体化治疗。
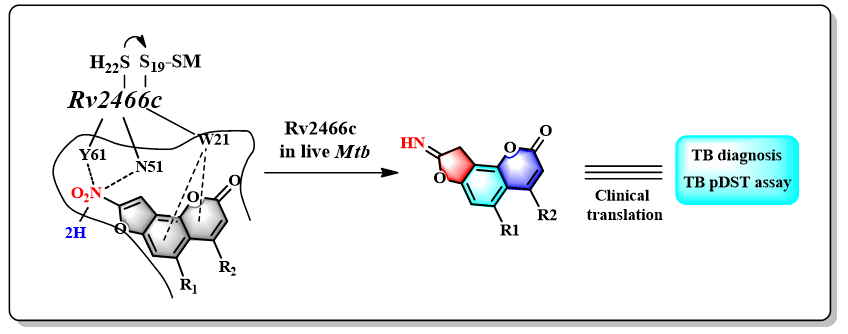
图3 Rv2466c依赖于MSH还原NFCs并释放荧光物质,可用于结核病的诊断和药物敏感性评价
总的来说,刘刚团队及其合作者的这三项研究成果,讲述了NFC类分子,从“具有抗结核活性”、到“治疗结核“再到“诊断结核“这一艰难而又精彩的“分子历程”。
清华大学药学院刘刚教授是本文的核心通讯作者。此外,首都医科大学附属北京胸科医院的孙照刚研究员合作研究讨论、临床实验的设计,为文章的共同通讯作者。刘刚课题组博士生穆然、孙照刚课题组硕士生孔成成、刘刚课题组博士生于文俊及博后王洪耀为论文的共同第一作者。完美体育·(中国)官方网站李海涛教授、美国康奈尔完美体育·(中国)官方网站Selin Somersan-Karakaya博士也参与了讨论,并给与了帮助。该研究得到了自然科学基金委、北京结构生物学高精尖创新中心、以及北京科技委员会基金的支持和帮助。
原文链接:https://pubs.acs.org.ccindex.cn/doi/10.1021/acsinfecdis.9b00006
