近期,清华大学药学院尹航团队鉴定到泛素化连接酶MARCH8通过泛素化修饰cGAS抑制cGAS与DNA的结合,进而负调控cGAS介导的天然免疫信号通路,提示了增强MARCH8的活性或MARCH8-cGAS相互作用可能是治疗某些自身免疫性疾病的策略。

图1.2022年5月3日《Science Signaling》封面。清华大学药学院尹航团队报道细胞质DNA传感器cGAS被E3泛素连接酶MARCH8修饰,阻止cGAS与DNA结合并抑制先天免疫反应。
细胞DNA识别受体环鸟苷酸-腺苷酸合成酶(cGAS)及其介导的cGAS-STING-IFN信号通路天然免疫应答反应在抗病毒感染和肿瘤免疫中发挥重要作用。机体适当的免疫反应可以维持免疫稳态,但cGAS的过度激活或功能缺陷会引发自身免疫性疾病如Aicardi-Goutieres综合征(AGS)和系统性红斑狼疮(SLE),以及HSV-1等病毒感染性疾病的发生。因此,cGAS的功能调控研究具有重要意义。泛素化修饰是蛋白翻译后修饰的重要形式,可参与调节蛋白的稳定性、酶活性、亚细胞定位和信号转导等。目前,针对cGAS泛素化修饰的功能调控形式仍然了解较少。
通过结合生信分析和生化实验验证,研究者筛选鉴定到泛素连接酶MARCH8直接结合cGAS并负调控其功能。通过敲降、敲除和过表达等一系列细胞系的构建和表型验证,他们发现MARCH8显著减弱了cGAS-STING通路的免疫信号激活。小鼠DNA病毒感染模型中,March8敲除小鼠对单纯疱疹病毒(HSV-1)感染的敏感性更低,表现出更强的抗病毒免疫反应并显著延长了生存期,这进一步验证了MARCH8对cGAS介导的抗DNA病毒感染能力的抑制作用。深入的机制研究表明,MARCH8依赖于其泛素化酶活性促进cGAS Lys411位点K63连接类型的多聚泛素化修饰。该位点的泛素修饰连接阻碍了cGAS与dsDNA的结合,降低了cGAS的合成酶活性和产物cGAMP的合成,并最终导致了DNA识别通路的干扰素免疫应答抑制。
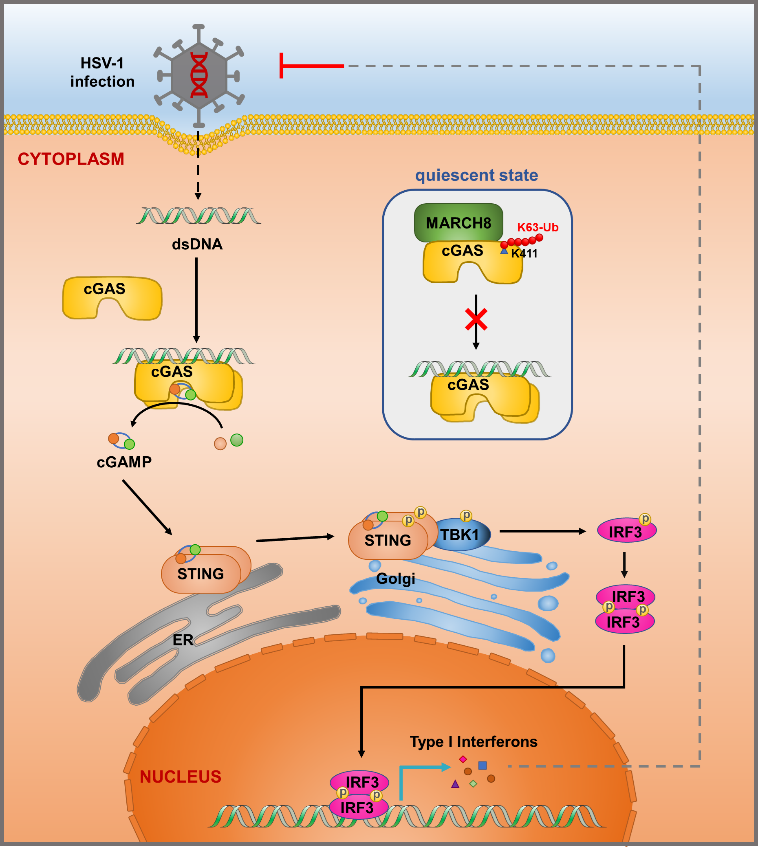
图2. MARCH8调控cGAS功能的作用模式
上述研究于2022年5月3日以封面故事在《Science Signaling》杂志上发表,标题为“MARCH8 attenuates cGAS-mediated innate immune responses through ubiquitylation(MARCH8通过泛素化修饰减弱cGAS介导的天然免疫反应)”。文章内容作为研究亮点被选作当期封面重点推荐(图1)。
文章通讯作者为清华大学药学院尹航教授,共同第一作者为清华大学化学系博士研究生杨熙康和药学院博士后施成瑞,其它贡献作者包括完美体育·(中国)官方网站博士生李鸿鹏、药学院博士后沈思奇和药学院博士生苏超飞。
清华大学药学院尹航课题组近年来致力于cGAS-STING介导的天然免疫信号通路的功能调控研究,并于近期接连取得重要进展。不久前,《The EMBO Journal》(2022年4月19日)杂志在线发表了尹航课题组题为“ZDHHC18 negatively regulates cGAS-mediated innate immunity through palmitoylation”的研究文章(EMBO J. 2022, e109272. doi:10.15252/embj.2021109272)。这项研究工作首次发现cGAS存在棕榈酰化修饰,揭示了该修饰调节cGAS活性的分子机制,并在细胞和小鼠模型中验证了在cGAS介导的抗DNA病毒感染过程中的调控作用。
截至目前,尹航课题组已经发现了两种cGAS的蛋白质修饰方式,棕榈酰化修饰和泛素化修饰,研究报道了ZDHHC18和MARCH8分别通过棕榈酰化修饰和泛素化修饰介导的cGAS功能负调控和天然免疫反应精细调节的新机制,为针对cGAS相关自身免疫性疾病的治疗和抗病毒感染治疗提供了新的靶点和治疗思路。
本系列研究项目感谢清华大学结构生物学高精尖创新中心、生命科学联合中心、国家自然科学基金与北京高校卓越青年科学家计划项目的经费支持,感谢清华大学药学技术中心和清华大学蛋白质研究技术中心的技术支持,尤其感谢北京大学生命科学学院蒋争凡教授和清华大学张从刚教授提供的技术支持,感谢实验室同学们为本研究提供的帮助。
原文链接:https://www.science.org/doi/10.1126/scisignal.abk3067
