胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)是死亡率最高的癌症之一,5年生存率仅有10%左右。近日,清华大学药学院钱锋课题组的研究关注到了在PDAC化疗耐药和免疫逃逸中扮演着重要角色的活化的胰腺星形细胞(Pancreatic stellate cell,PSC),发现活化的PSC中自噬上调和与之相伴的p62丢失是阻碍维生素D受体(Vitamin D receptor,VDR)信号通路重塑PSC的重要原因。以此为基础,研究人员提出了“协同自噬阻断和VDR信号通路激活”的PSC重塑策略,以具有精准、强效抑制自噬功能的溶酶体pH缓冲胶束(Lysosomal pH buffering micelle,LBM)递送VDR配体卡泊三醇(Calcipotriol,Cal),同时实现了自噬阻断和VDR信号通路激活。这一策略协同调控了PSC重塑,改变了PDAC高度纤维化和免疫抑制的微环境,提高了PDAC对化疗、免疫疗法的响应性(图1)。
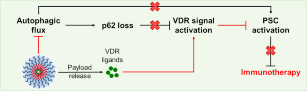
图1.包载Cal的LBM(Cal-loaded LBM,C-LBM)协同重塑PSC示意图
将活化的PSC“重塑/正常化/去活化”为静息状态,是改变PDAC抑制性肿瘤微环境的重要途经。为探索高效的PSC重塑策略,该研究首先对PSC活化过程中的生物学现象进行了分析。研究发现,肿瘤组织中活化的PSC具有显著上调的自噬水平并伴随有p62蛋白的下调(图2A-D)。为更好地探索自噬、p62和VDR信号通路在PSC活化中的关系,该研究构建了p62敲低的PSC,发现在p62敲低的PSC中,VDR配体Cal无法激活VDR信号通路(图2E),p62的丢失也抑制了Cal去活化PSC的能力(图2F-G),说明了PSC中上调的自噬和与之相伴的p62丢失是造成PSC对VDR配体不敏感的重要原因。该部分是研究的生物学基础,基于上述的生物学发现,该研究提出了协同自噬抑制和VDR信号通路激活的PSC重塑策略。
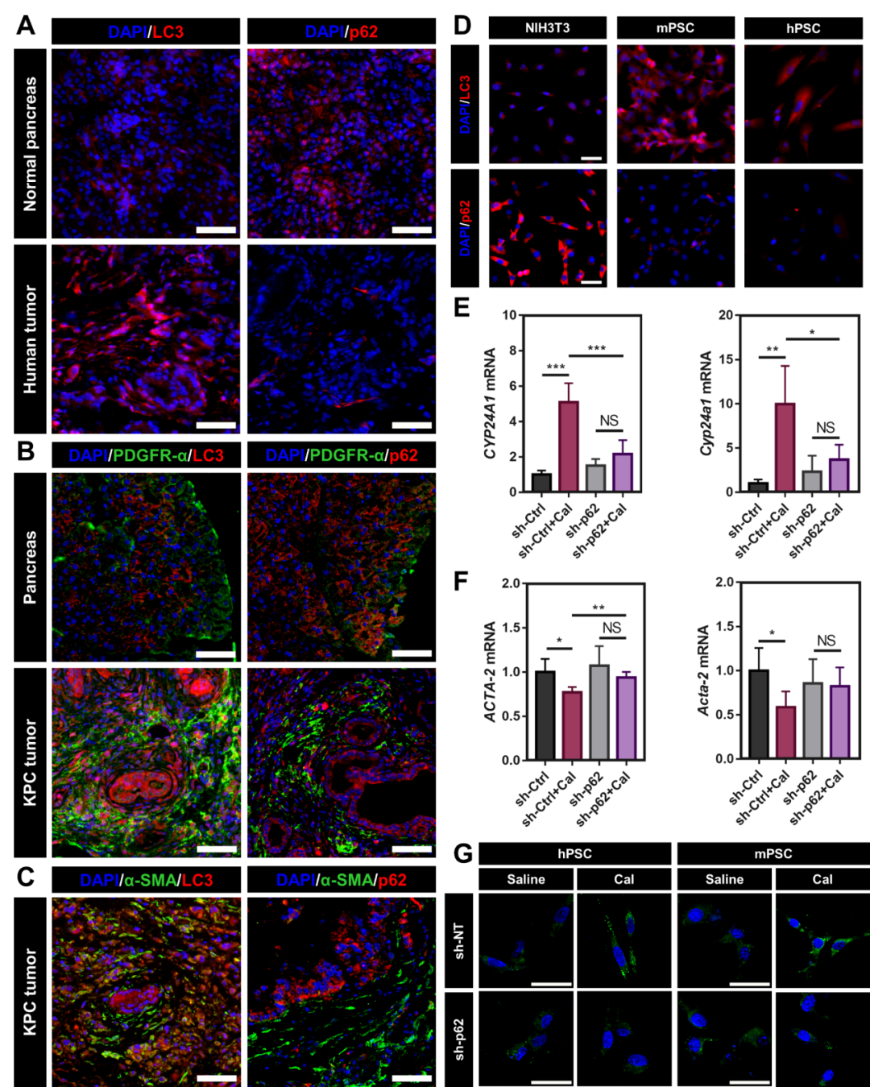
图2. 增强的自噬和p62丢失是阻碍VDR信号通路重塑PSC的重要原因
为实现协同的自噬抑制和VDR信号通路激活,该研究以具有精准、强效pH缓冲作用的LBM为自噬抑制剂,通过LBM包载VDR配体Cal,构建了C-LBM(图3A)。C-LBM保留了LBM精准、强效的pH缓冲作用(图3B),并能够响应酸性溶液环境快速释放Cal(图3C)。更重要的是,在活化的PSC中,C-LBM同样高效抑制了自噬并逆转了p62的丢失(图3D),实现了增强的VDR信号通路激活(图3E)。该部分是研究的制剂基础,递送系统的合理设计使得从药学角度对协同重塑PSC策略的评估成为可能。
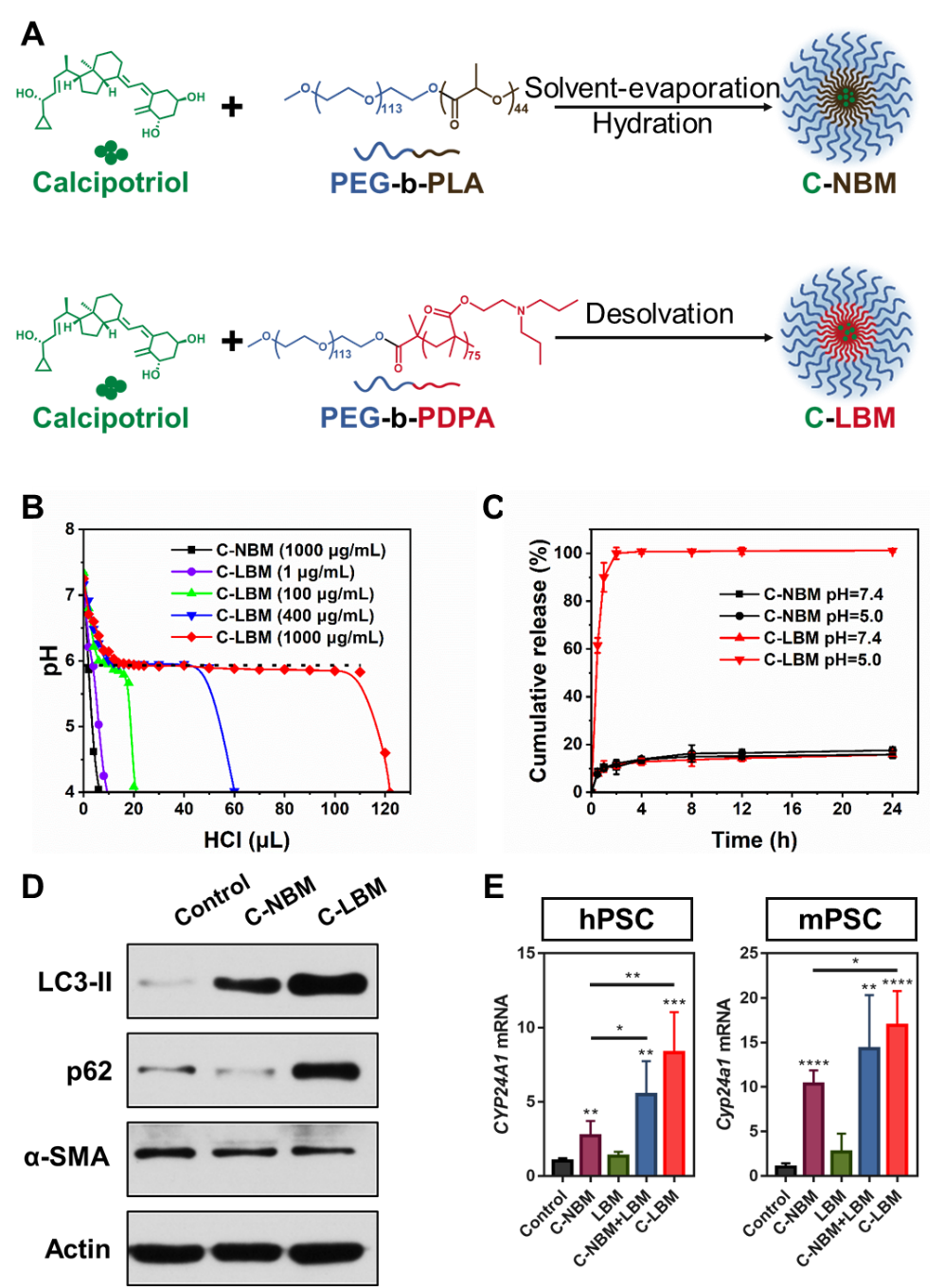
图3. C-LBM能够同时抑制PSC自噬并激活VDR信号通路
使用C-LBM处理PSC,C-LBM显著下调了PSC的α-SMA表达并增加了胞内脂滴的数量,且程度明显高于单独的VDR配体C-NBM和单独的自噬抑制剂LBM,说明了C-LBM协同增效的PSC重塑作用(图4)。该部分在细胞水平上对协同重塑策略进行了验证,C-LBM展现出的强效重塑PSC作用为基于该治疗策略的抗癌体内研究奠定了基础。
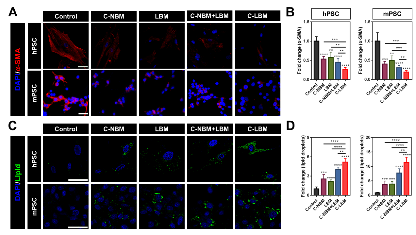
图4. C-LBM实现了协同增效的PSC重塑
为评估协同重塑PSC策略在体内研究中的表现,该研究构建了同样具有高度纤维化微环境的PSC/PCC共移植小鼠模型。与在体外研究中的结果一致,C-LBM高效重塑了PSC。虽然C-LBM本身并不能显著抑制肿瘤增长,但通过重塑肿瘤基质,C-LBM显著提高了PDAC对一线化疗药物吉西他滨(GEM)的响应性,C-LBM联合GEM明显抑制了肿瘤增长(图5)。
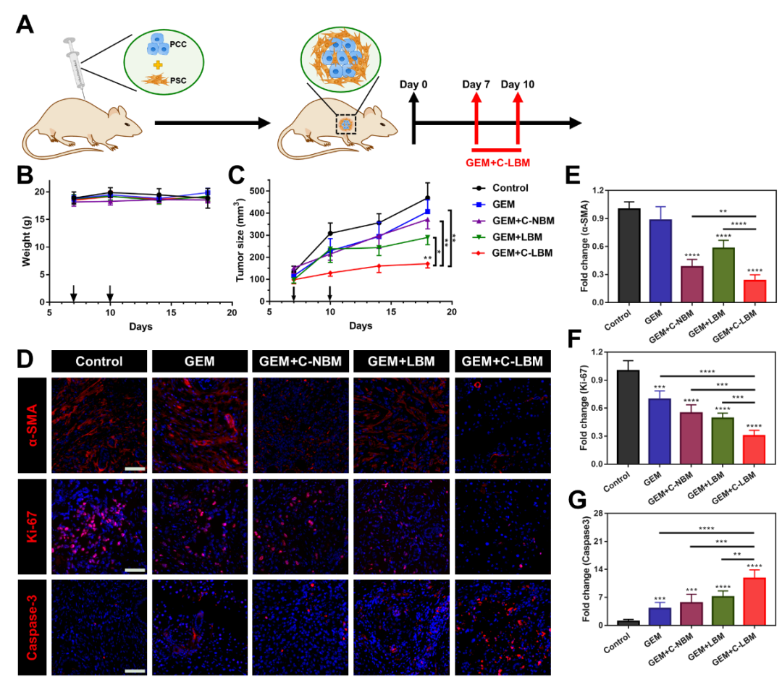
图5. C-LBM提高了PDAC对化疗的响应性
免疫疗法引发了抗癌新一轮变革,为评估协同重塑策略对免疫疗法的影响,该研究构建了同样具有复杂、免疫抑制性微环境的KPC同种移植瘤模型。C-LBM显著促进了CD8+ T细胞的浸润。更重要的是C-LBM显著提高了PDAC对免疫疗法的响应性,C-LBM联合anti-PD1、GEM也将患癌小鼠的生存期提升了2倍(图6)。
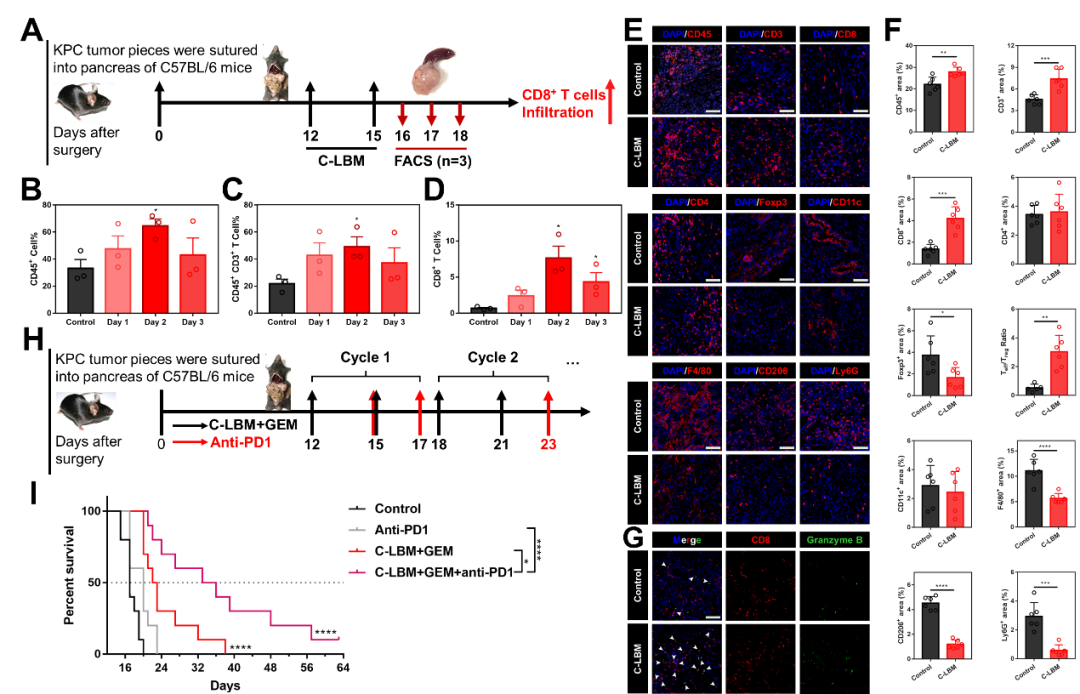
图6. C-LBM改变了免疫抑制性微环境并提高了PDAC对免疫疗法响应性
综上所述,该研究以PDAC未被满足的临床需求为导向,以肿瘤微环境中对化疗耐药、免疫逃逸至关重要的PSC为突破口,以PSC活化过程中的生物学机理为基础,提出了“协同自噬阻断和VDR信号通路激活”的PSC重塑策略。该研究选择具有精准、强效pH缓冲作用的LBM作为自噬抑制剂,选择VDR配体Cal作为VDR信号通路激活剂,设计构建了能同时实现自噬抑制和VDR信号通路激活的药物递送体系,实现了高效PSC重塑,提高了PDAC对化疗、免疫疗法的响应性。这一尝试为未来的PDAC药物设计和治疗方案提供了潜在的新方向。
上述研究在《Cancer Letters》发表,标题为“Synergistic Autophagy Blockade and VDR Signaling Activation Enhance Stellate Cell Reprogramming in Pancreatic Ductal Adenocarcinoma”。
清华大学药学院钱锋教授为本文通讯作者,钱锋课题组2017级博士生孔维健为本文第一作者。感谢北大药学院汪贻广教授和王增辉博士提供高分子胶束制剂材料,钱锋研究组开展的针对胰腺癌的药物递送研究获得了中国国家自然科学基金(项目号82073769),北京结构生物学高精尖中心的资助。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0304383522002026
