2022年9月30日,清华大学尹航课题组应Chemical Communications邀约,在Emerging Investigator十周年回顾特刊上发表了题为“Protein phosphatase 1 regulates phosphorylation of gasdermin D and pyroptosis(磷酸酶PP1调节gasdermin D蛋白的磷酸化和细胞焦亡)”的研究论文(DOI: 10.1039/d2cc03590a)。该工作发现了磷酸化修饰对GSDMD调控免疫细胞焦亡的突出贡献,磷酸酶PP1通过去磷酸化调节GSDMD-NT,影响GSDMD-NT寡聚,进而调控细胞焦亡。

细胞焦亡是一种裂解性细胞死亡方式,诱导炎症反应,对机体抵御感染和危险信号十分重要。Gasdermin家族蛋白(gasdermin A-E)是细胞焦亡的执行蛋白,该家族蛋白由N端和C端结构域组成,中间由连接链连接。它们的N端可以定位细胞膜打孔具有细胞毒性,而在通常情况下蛋白的N端受C端的结合抑制。当炎性caspase活化时,蛋白N端和C端之间的连接链被切割,蛋白N端与细胞膜上的酸性磷脂结合、自身寡聚形成孔道,一些细胞因子如IL-1β,IL-18能通过该孔道运输到胞外。目前发现了多种调控细胞焦亡的机制,这些研究主要集中在GSDMD上游的调控,关于GSDMD被切割后的调节机制还不明确。
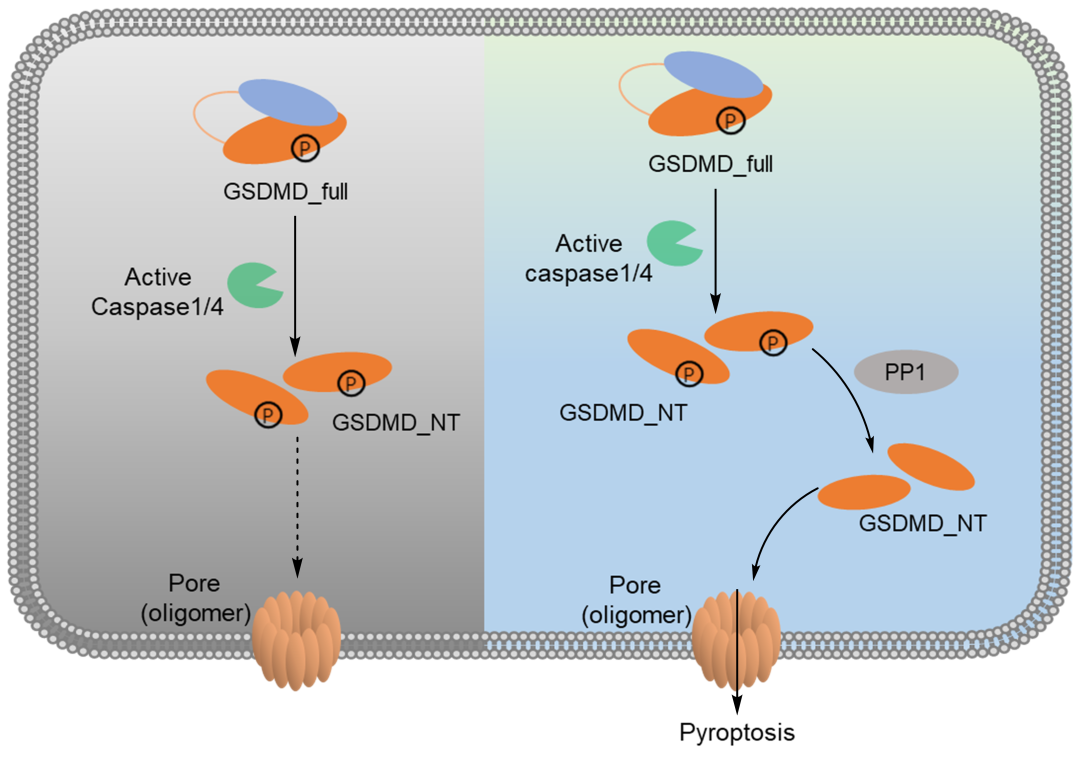
图1. 磷酸酶PP1调控GSDMD的功能
运用蛋白质谱,尹航课题组鉴定到GSDMD的多个磷酸化修饰位点。通过构建突变体进行表型验证,发现了包括T213在内的磷酸化修饰明显抑制细胞焦亡。利用已被解析的GSDMD-NT晶体结构,分析磷酸化修饰对其功能的调节,发现这些位点能影响与膜磷脂的结合及蛋白寡聚体的形成。利用体外实验证实T213位点磷酸化不影响其与膜磷脂的结合但能抑制蛋白寡聚,磷酸化修饰导致空间位阻的增加可能是抑制蛋白寡聚体形成的主要原因。机制研究发现磷酸酶PP1与GSDMD相互作用,通过敲降和过表达等细胞系的构建和表型验证,发现PP1在GSDMD被切割后对其去磷酸化,从而使GSDMD-NT寡聚诱导焦亡。
文章的通讯作者为清华大学药学院尹航教授,共同第一作者为清华大学药学院博士后李盈和普德兵,其他贡献作者包括清华大学化学系黄健博士和药学院张莹老师。感谢清华大学结构生物学高精尖创新中心、生命科学联合中心、国家自然科学基金,北京高校卓越青年科学家计划和北京市自然科学基金项目的经费支持,感谢清华大学蛋白质研究技术中心的技术支持,感谢实验室同学们为本研究提供的帮助。
