
2023年3月15日,清华大学药学院张从刚课题组与合作者在美国癌症研究协会(AACR)旗下学术期刊Cancer Immunology Research发表了题为“Discovery of Podofilox as a Potent cGAMP–STING Signaling Enhancer with Antitumor Activity”的研究论文。该研究通过高通量筛选,发现一系列微管去稳定剂(如:Podofilox、Nocodazole、Colchicine、 Vincristine sulfate等),均能显著增强多种STING激动剂介导的天然免疫反应,进而发挥强大的抗肿瘤作用。该团队以FDA批准临床抗病毒外用药Podofilox为代表性分子深入解析了微管去稳定剂调控cGAMP-STING通路的分子机理,发现Podofilox通过抑制微管聚合、分散高尔基体、改变了STING激活后从ER到高尔基体的转运路线。其次,Podofilox延缓STING降解,持续可控地放大STING依赖的I型干扰素信号进而促进肿瘤特异性T细胞浸润,并改善了肿瘤微环境。
该团队将微管去稳定剂与STING激动剂联合用于肿瘤免疫治疗领域,并以Podofilox和cGAMP作为概念性证据,揭示了微管去稳定剂+STING激动剂在多种肿瘤模型(包括人肺癌类器官模型)中具有惊人的抗肿瘤治疗效果。该研究提示可以通过STING激动剂和微管去稳定剂的精准联用,从而启动持续的STING天然免疫激活。考虑到众多微管去稳定剂正在用于临床癌症治疗,该发现具有广泛的开发潜力和应用前景,有望为癌症免疫治疗提供全新的联合治疗方案。
研究背景
cGAS-STING通路是天然免疫信号通路识别细胞质异常DNA的主要传感机制[1]。在哺乳细胞中cGAS与DNA结合后被激活,催化合成独特的第二信使分子cGAMP。cGAMP与干扰素基因刺激因子(STING)结合后,招募并激活TBK1和IRF3,进而诱导I型干扰素(IFNs)和其他细胞因子的产生[2]。IFNs的产生能诱导数百种IFNs—刺激基因(ISGs)的表达,这对培养持续的肿瘤特异性T细胞极其重要[3],[4]。因此,STING成为癌症免疫治疗的潜在靶点。
尽管有效的STING激动剂被开发(包括环二核苷酸类,非核苷酸类化学小分子,ADC偶联的STING激动剂等),但STING激动剂,以及激动剂与PD-1/PD-L1联用的临床抗肿瘤试验结果并不理想;最近报道的ADC偶联的STING激动剂药物 XMT-2056在一期临床试验中出现了致命的副作用。因此,STING激动剂的开发任重道远,需要继续探索新的治疗策略,以期望控制过度的免疫激活、降低免疫抑制和毒副作用,从而用于癌症免疫治疗。
研究成果
该研究团队首先以cGAS-STING天然免疫通路激活为表型,对市售小分子库进行高通量筛选(~150,000 compounds),发现了一个非常有趣的现象,多种结构不同的微管去稳定剂(或称微管解聚剂),包括常用的长春花生物碱家族、秋水仙碱和MMAE等,能显著增强cGAMP-STING信号通路。随后,研究者对比微管稳定剂(Paclitaxel、Docetaxel)和DNA拓扑异构酶(Etoposide、Topotecan)对该通路的影响,发现仅有微管去稳定剂能显著增强cGAMP-STING信号转导(图1)。其中, Podofilox对cGAMP-STING信号通路的增强作用最为显著,且具有严格的浓度依赖性(有效协同浓度低至nM浓度水平)。
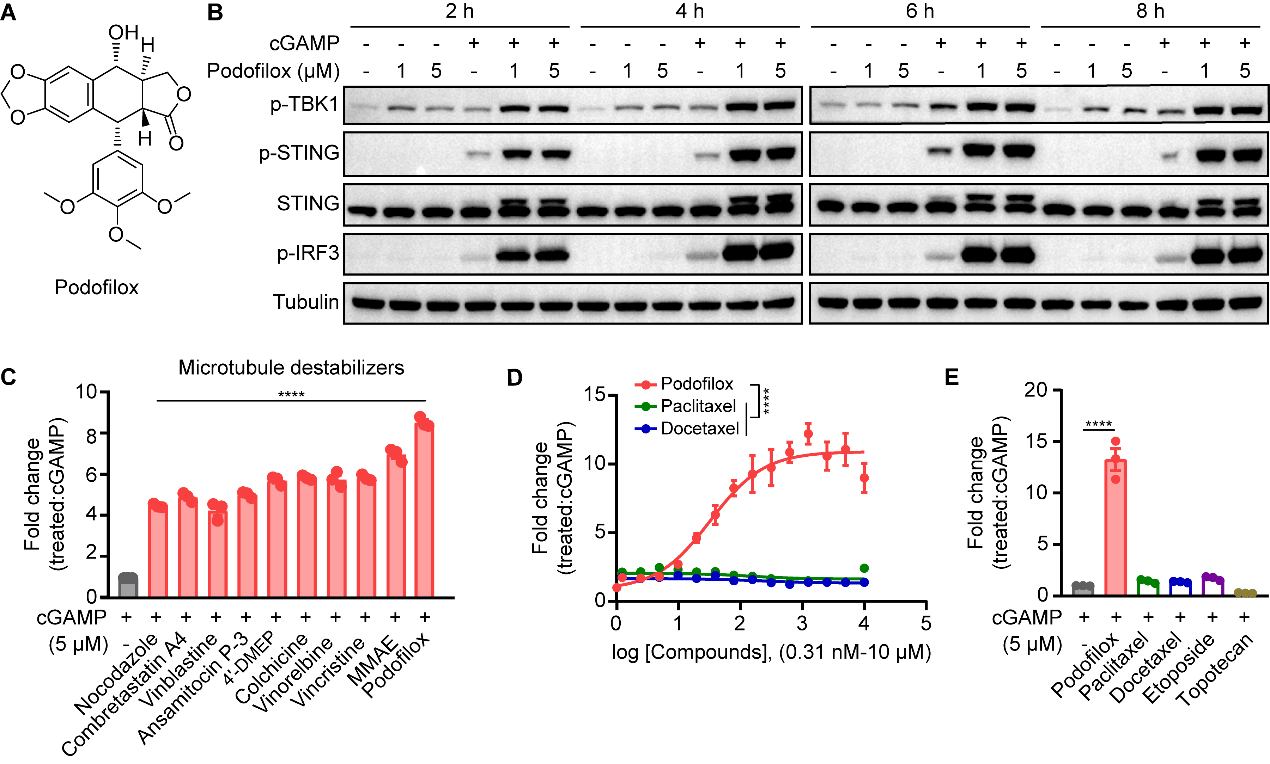
图1. 仅有微管去稳定剂能增强cGAMP-STING信号
接下来,该研究团队探究Podofilox对不同STING激动剂(CDNs、DMXAA、STING-agonist-3)介导天然免疫反应的作用。此外,为了判定Podofilox对cGAMP-STING通路作用的特异性,研究者通过基因敲除(STING KO),小分子或仙台病毒(SeV)等(LPS诱导TLR通路激活;Poly(I:C)和SeV诱导RNA通路激活)诱导不同天然免疫通路的激活,进一步确定Podofilox能特异性增强STING信号级联,并显著促进I型干扰素产生和ISGs基因表达(图2)。
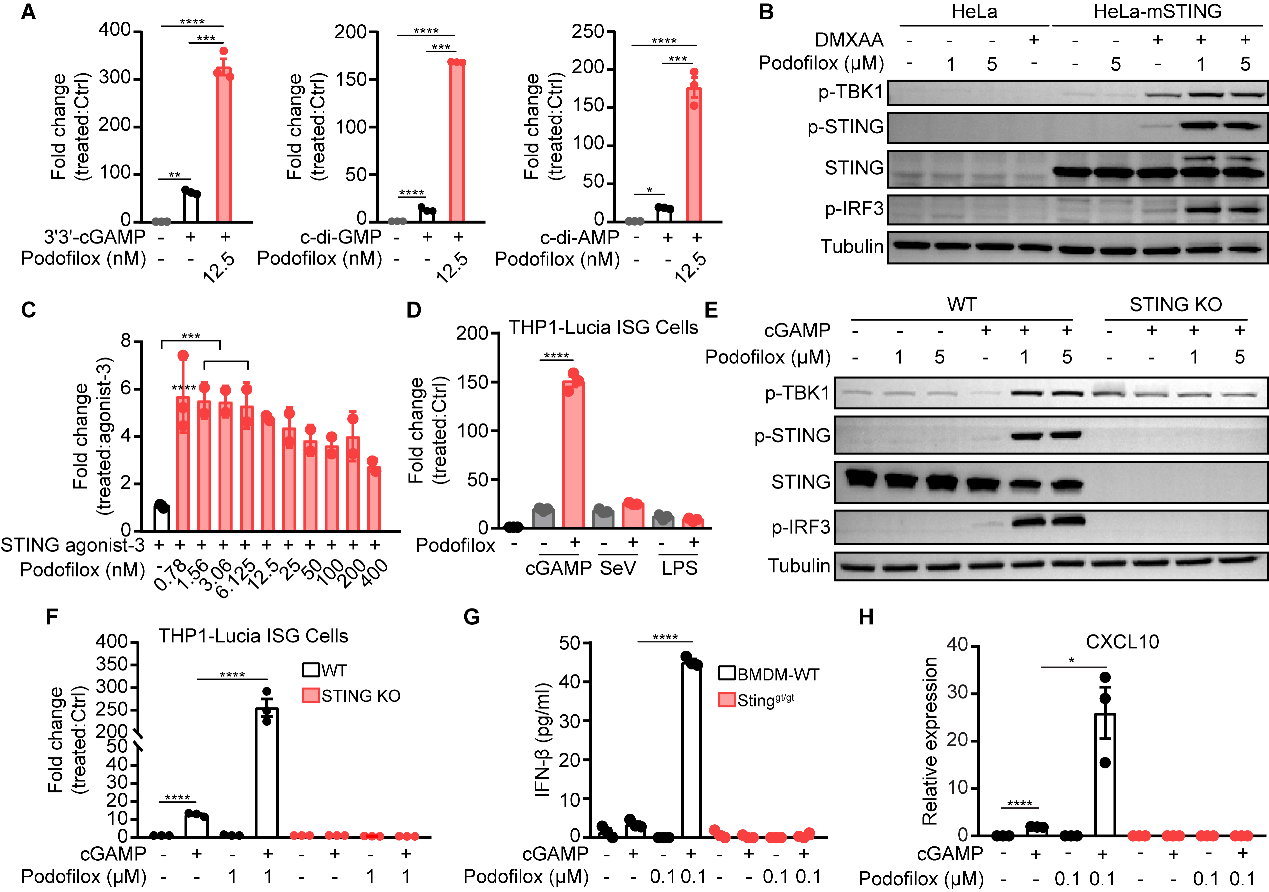
图2. Podofilox特异性增强STING依赖的IFNs信号通路
由于间接IFN-α/β受体(IFNAR)信号通路也能介导ISGs基因的表达。研究者通过使用anti-IFNAR2抗体拮抗间接信号通路、基因敲除(Stat1 KO、Stat3 KO),以及IFNAR2激动剂(RO8191)刺激等方式,进一步确定Podofilox通过经典的STING-TBK1-IRF3信号轴促进了ISGs基因的表达(图3)。
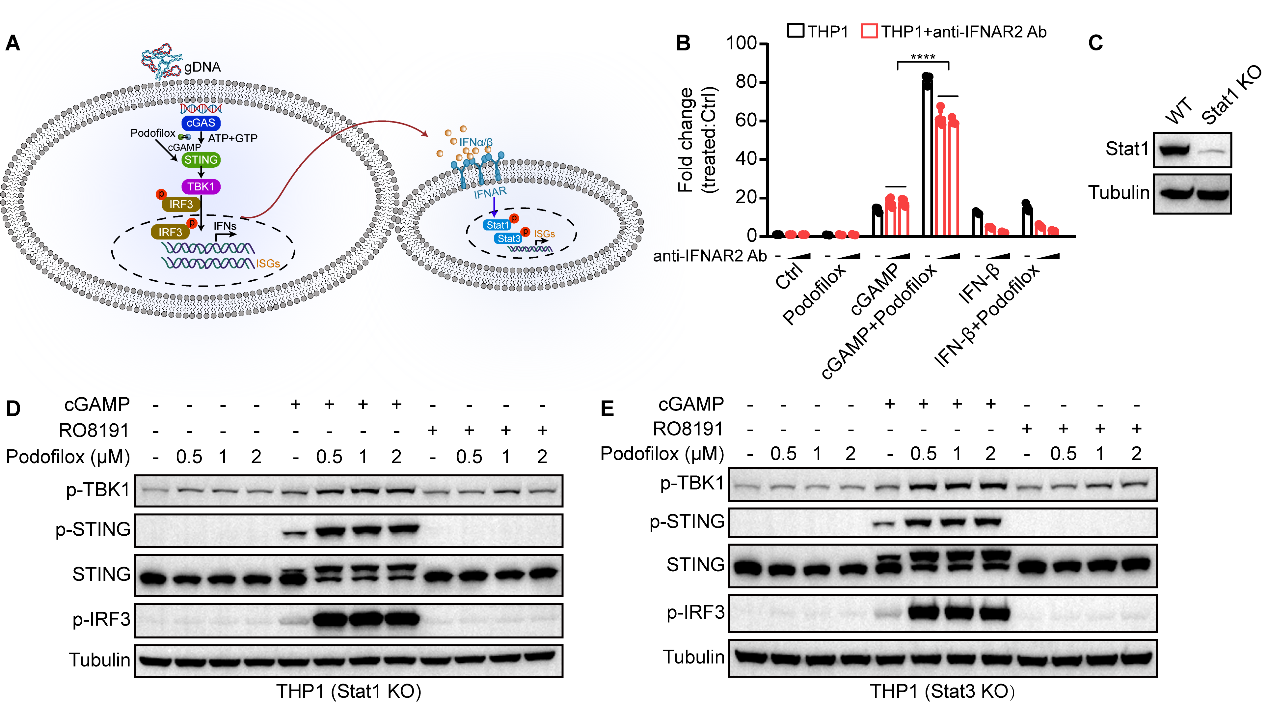
图3. Podofilox主要通过直接的STING信号通路增强cGAMP介导的免疫反应
接下来,研究者系统性解析了Podofilox增强STING信号的分子机理。研究者首先通过构建稳定表达STING-GFP的细胞系可视化了STING激活后的转运过程,发现Podofilox分散了cGAMP介导的STING核周puncta为贯穿整个细胞质的微小囊泡,在这些囊泡中诱导更强的STING寡聚化及TBK1、IRF3的磷酸化(图4)。
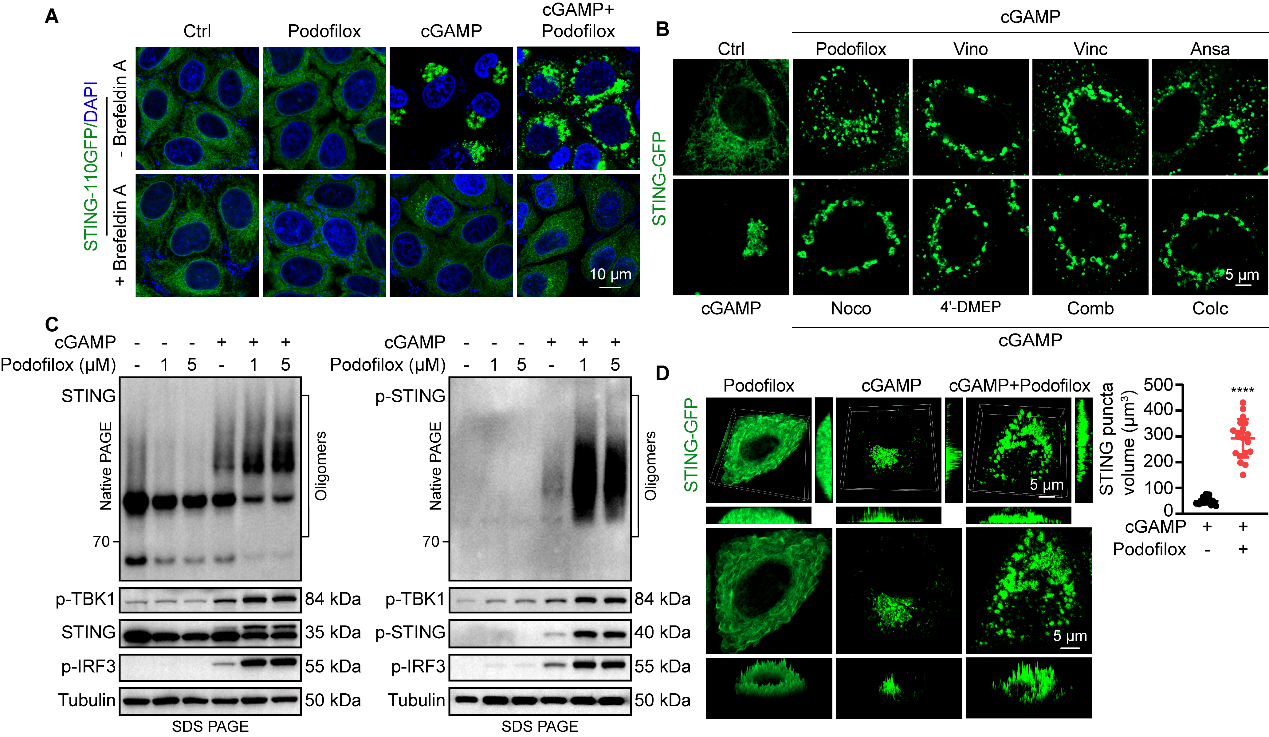
图4. Podofilox增加STING puncta数量,持续增强cGAMP-STING信号通路
研究者猜想,这些微管解聚剂诱导的STING散点表型可能通过破坏微管网络,扰乱了STING激活后囊泡在细胞内的正常运输。不出所料,我们通过超高分辨成像、免疫染色,及活细胞的延时拍摄发现cGAMP刺激后STING在60 min内从ER转运至高尔基体,并最终到达溶酶体被降解终止信号。然而,Podofilox通过抑制微管聚合,分散高尔基体改变了cGAMP刺激后STING转运模式,并显著延缓转运中启动的STING降解和信号关闭(图5)。
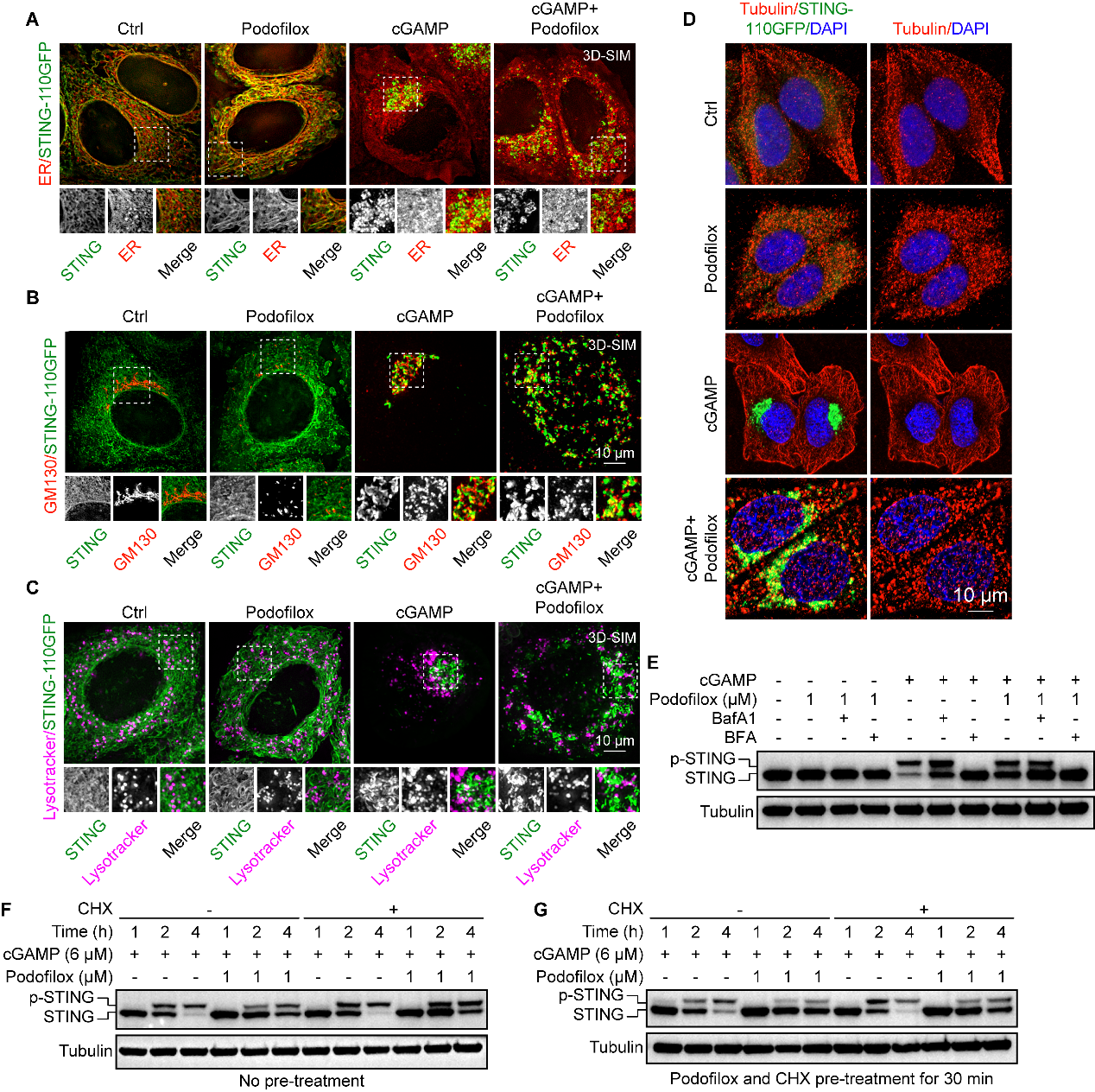
图5. Podofilox通过抑制微管聚合,分散高尔基体,改变了STING激活后的转运路线并显著延缓了STING降解
此外,Podofilox增强cGAMP介导的免疫反应是否能应用于肿瘤的免疫治疗呢?研究者分别在人肺癌类器官,小鼠肿瘤模型(B16F10黑素瘤;4T1乳腺癌)中进一步探究微管去稳定剂和STING激动剂联合的抗肿瘤疗效。该团队的研究结果表明,Podofilox以宿主STING依赖的方式促进cGAMP抗肿瘤活性和淋巴细胞免疫浸润,并改善了肿瘤免疫微环境进而发挥了强大的抗肿瘤作用,尤其是二者与PD-L1抗体联合能进一步扩大治疗效果。此外,在肿瘤类器官上的抗肿瘤作用强于肺癌一线化疗药Gemcitabine + Cisplatin。这些数据表明,微管去稳定剂与STING激动剂联合可能在治疗癌症方面拥有巨大的潜力(图6)。
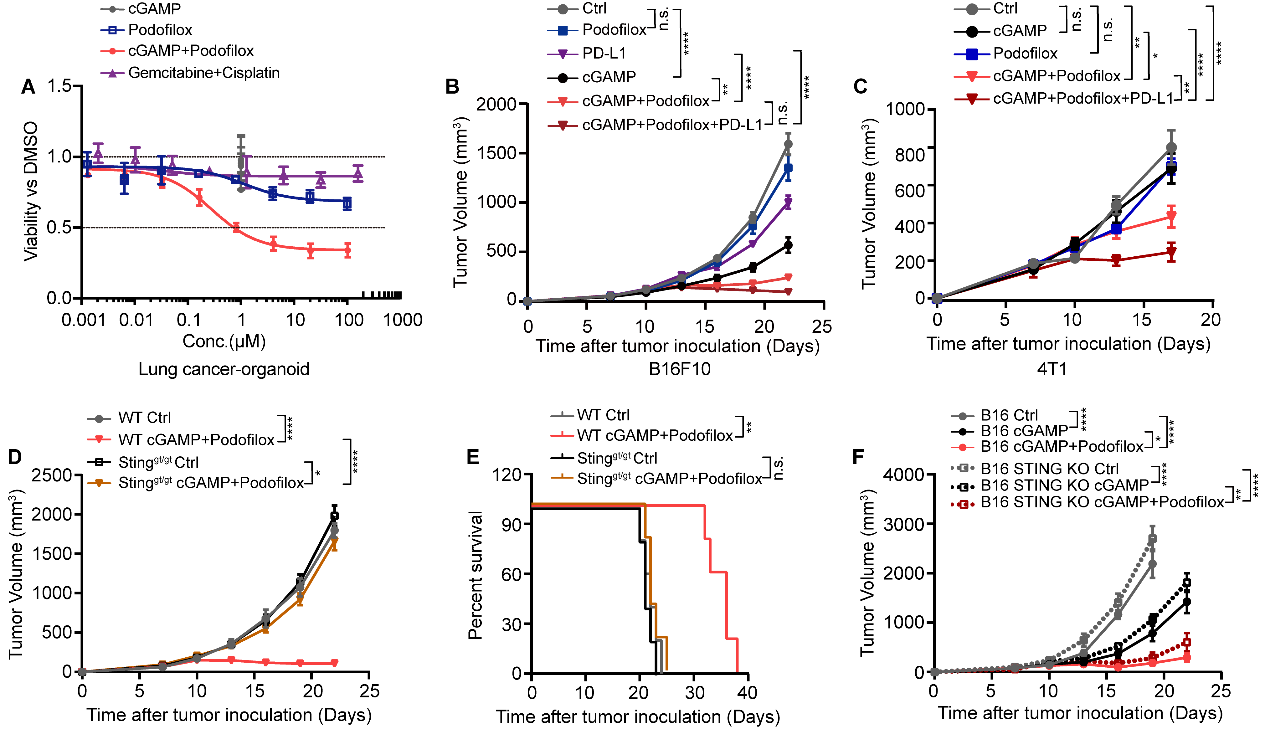
图6. Podofilox以宿主STING依赖的方式在体内增强了cGAMP的抗肿瘤作用
综上所述,该研究深入解析了微管去稳定剂增强cGAMP-STING通路的分子机理。明确表明Podofilox通过抑制微管聚合,破坏STING激活后囊泡的正常转运并显著延缓了STING降解,进而诱导了更多的I型干扰素(IFNs)产生和更强的抗肿瘤免疫。在肿瘤模型中,Podofilox通过IFNs依赖的T细胞激活抑制肿瘤生长,并促进肿瘤内T细胞浸润和PD-L1表达,这项研究扩大了肿瘤免疫治疗的益处,并可能为临床癌症的治疗提供指导意义。
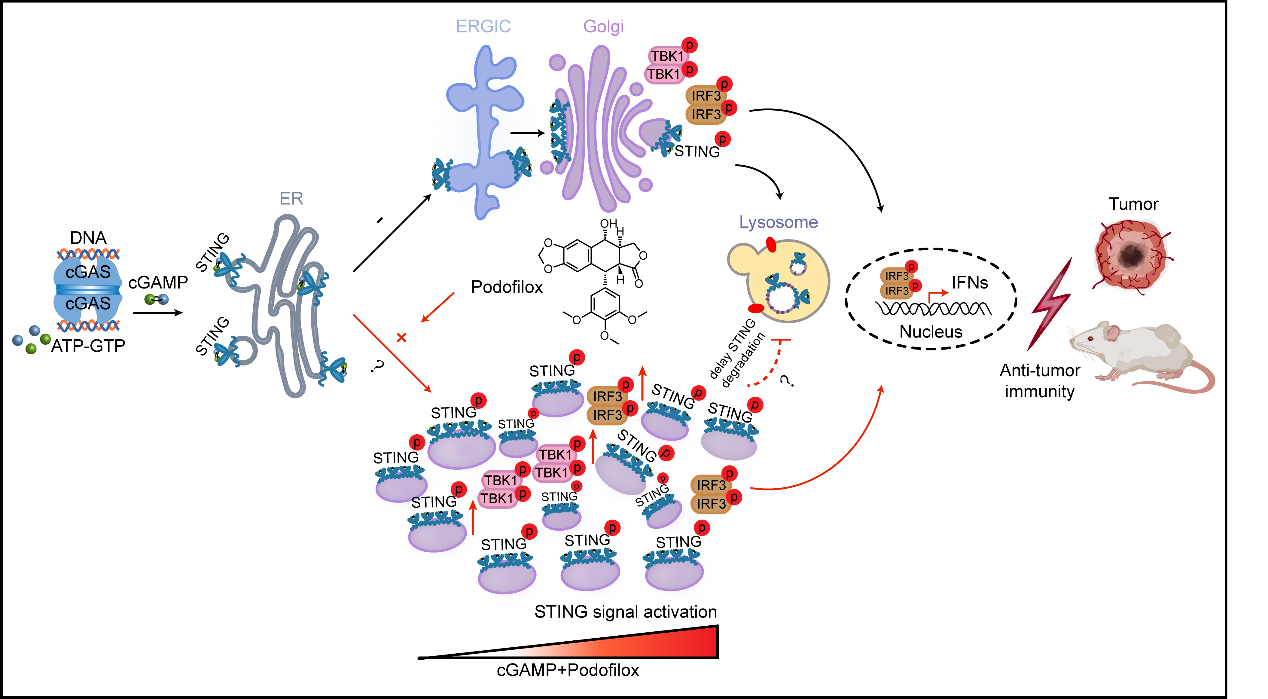
模式图. Podofilox破坏微管网络分散cGAMP介导的STING puncta进而放大STING信号级联发挥抗肿瘤作用
清华大学药学院张从刚课题组博士后韩晶、UTSW的胡水清和完美体育·(中国)官方网站博士后胡亚伟为本研究共同第一作者。清华大学药学院张从刚研究员、完美体育·(中国)官方网站刘鹏研究员和上海交通大学基础完美体育·(中国)官方网站孙序序研究员为该论文通讯作者。
参考文献
1. Cai X, Chiu YH, Chen ZJ. The cGAS-cGAMP-STING pathway of cytosolic DNA sensing and signaling. Mol Cell 2014;54(2):289-96 doi 10.1016/j.molcel.2014.03.040.
2. Woo SR, Fuertes MB, Corrales L, Spranger S, Furdyna MJ, Leung MY, et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity 2014;41(5):830-42 doi 10.1016/j.immuni.2014.10.017.
3. Hemann EA, Green R, Turnbull JB, Langlois RA, Savan R, Gale M, Jr. Interferon-lambda modulates dendritic cells to facilitate T cell immunity during infection with influenza A virus. Nat Immunol 2019;20(8):1035-45 doi 10.1038/s41590-019-0408-z.
4. Motwani M, Pesiridis S, Fitzgerald KA. DNA sensing by the cGAS-STING pathway in health and disease. Nat Rev Genet 2019;20(11):657-74 doi 10.1038/s41576-019-0151-1.
5. Gui X, Yang H, Li T, Tan X, Shi P, Li M, et al. Autophagy induction via STING trafficking is a primordial function of the cGAS pathway. Nature 2019;567(7747):262-6 doi 10.1038/s41586-019-1006-9.
原文链接:https://aacrjournals.org/cancerimmunolres/article/doi/10.1158/2326-6066.CIR-22-0483/718784/Discovery-of-podofilox-as-a-potent-cGAMP-STING
