2023年3月31日,清华大学药学院王钊教授课题组以“Overexpressed SIRT6 ameliorates doxorubicin-induced cardiotoxicity and potentiates the therapeutic efficacy through metabolic remodeling”为题在药学领域权威期刊Acta Pharmaceutica Sinica B发表研究论文。该论文报道了去乙酰化酶SIRT6可作为一种有效的治疗靶点,在减轻蒽环类药物心脏毒性的同时增强其抗肿瘤活性;机制上,该研究发现SIRT6通过诱导细胞代谢模式转变,即增强线粒体呼吸、降低糖酵解活性,从而在心肌细胞和肿瘤细胞“生存还是灭亡”的命运决定中具有截然不同的作用;进一步,该研究发现SIRT6通过去乙酰化抑制下游基因Sgk1从而改善线粒体功能的分子机制。该研究为缓解蒽环类抗肿瘤药物的心脏毒性提供了一种可行的临床干预策略,并为肿瘤的临床治疗提供一种更为安全的新思路。
研究背景
随着药学技术的不断进步,肿瘤患者的生存期逐渐延长,但药物副作用引起的并发症导致患者的生活质量严重下降。其中,心血管疾病是肿瘤治疗过程中最常见的并发症之一,多由蒽环类药物(anthracyclines)等常规治疗手段引起。目前临床治疗中常见的蒽环类药物包括多柔比星(doxorubicin)、伊达比星(idarubicin)、表柔比星(epirubicin)等,其对多种实体瘤和血液肿瘤均有较好的疗效。然而,蒽环类药物也具有较为严重的心脏毒性,这给临床治疗工作带来很大的困难,有时甚至因为心血管副作用的出现而不得不停药,因而延误肿瘤患者的治疗。因此,如何在有效降低蒽环类药物毒副作用的同时不影响其抗癌活性,是目前亟待解决的关键问题。
SIRT6(Sirtuin 6)是一种NAD+依赖的去乙酰化酶,其被证实可对组蛋白H3K9、H3K18和H3K56进行去乙酰化修饰,进而在细胞代谢、DNA损伤修复、炎症反应以及肿瘤发生发展等多个生理进程中发挥重要作用。本研究以多柔比星作为蒽环类药物的代表,探究SIRT6对多柔比星心脏毒性和抗肿瘤活性的影响,并尝试阐明SIRT6发挥作用的分子机制,为SIRT6作为临床治疗中的新型药物靶点提供理论依据。
主要研究结果
1. 基于蒽环类药物的化疗方案降低患者血浆中SIRT6表达量
蒽环类药物是多种实体瘤和血液肿瘤的常规治疗药物之一。本研究中,选取了入院前未经任何放化疗的10位乳腺癌患者,在入院时采集第一次血样,并在经过4个周期基于蒽环类药物的化疗方案治疗后再次采集血样。结果显示,这些患者经过治疗后血浆中SIRT6的表达量显著低于未治疗时血浆中SIRT6的表达量。该结果证实了蒽环类药物应用与SIRT6表达水平之间具有相关性,提示我们该靶点在临床治疗中的潜在价值。
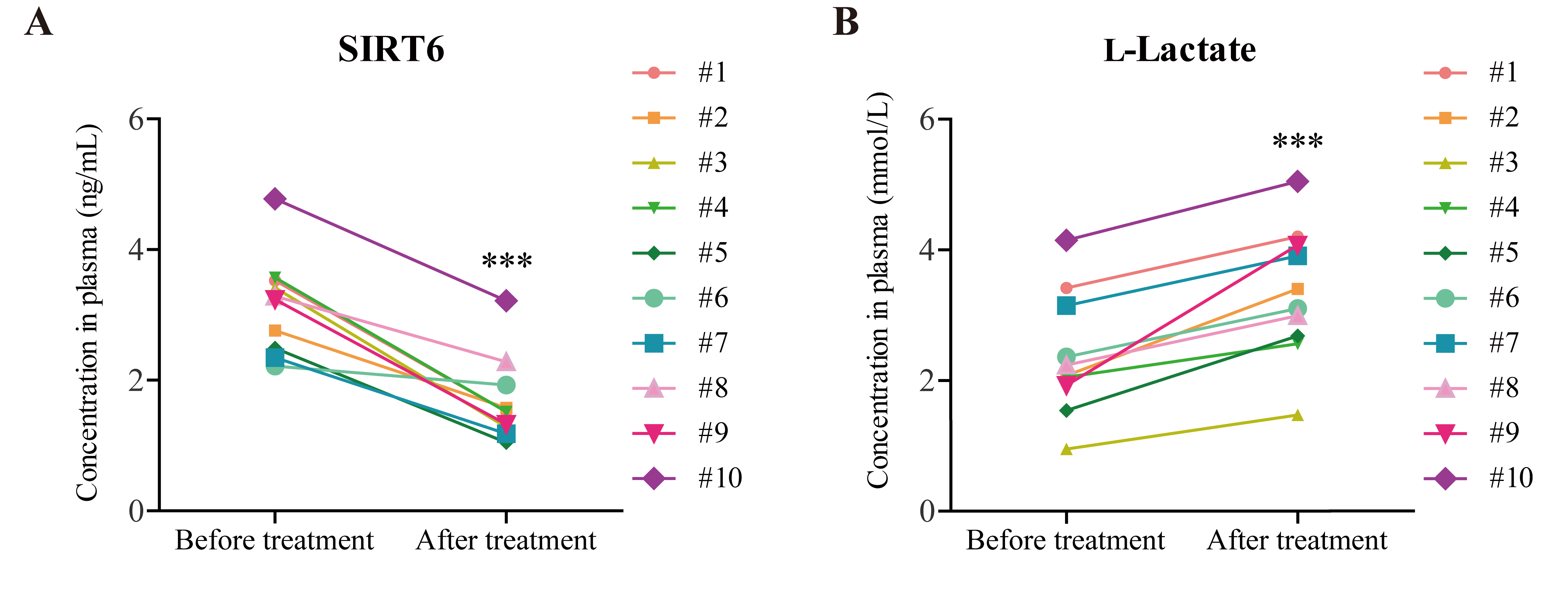
图1 基于蒽环类药物的化疗方案降低患者血浆中SIRT6表达量
2. SIRT6过表达的心肌细胞和肿瘤细胞呈现多柔比星敏感性差异
为了明确SIRT6这一靶点在蒽环类药物多柔比星所介导的心脏毒性和抗肿瘤活性中的作用,通过慢病毒载体构建多种SIRT6过表达细胞系,发现SIRT6过表达可显著降低多柔比星对心肌细胞的毒性,并增强多柔比星对肿瘤细胞的毒性。同时,通过提取SIRT6过表达小鼠及其同窝野生型小鼠的原代心肌细胞和心肌成纤维细胞,进一步证实了SIRT6过表达可显著降低多柔比星对心肌细胞的毒性。

图2 SIRT6过表达降低多柔比星的心肌细胞毒性并加剧其肿瘤细胞毒性
3. SIRT6过表达缓解多柔比星所致心脏毒性
为了明确SIRT6在多柔比星心脏毒性中的作用,以SIRT6过表达小鼠模型为研究对象,首先使用小剂量、连续5周给药的方法,模拟临床治疗中多柔比星引起的常规心脏毒性。结果发现,SIRT6过表达可显著缓解多柔比星引起的左室功能障碍和心力衰竭等症状,并可有效降低多柔比星引起的心肌纤维化和心肌细胞凋亡,这些数据表明SIRT6过表达可有效缓解多柔比星引起的多种心脏毒性症状。
接着使用大剂量、连续2周给药的方法,模拟临床治疗中多柔比星引起的急性心脏毒性。结果发现,SIRT6过表达可显著延长多柔比星治疗小鼠的生存期,进一步证实了SIRT6过表达是缓解多柔比星的心脏毒性的一个有效策略。

图3 SIRT6过表达缓解多柔比星所致心脏毒性
4. SIRT6过表达增强多柔比星的抗肿瘤活性
为了明确SIRT6在多柔比星抗肿瘤活性中的作用,以肿瘤移植小鼠模型为研究对象,发现SIRT6过表达可显著增强多柔比星对肿瘤生长的抑制作用,同时促进肿瘤细胞的凋亡。上述结果表明SIRT6过表达可显著增强多柔比星的抗肿瘤活性,证实了其作为一种新型化疗辅助策略的有效性。

图4 SIRT6过表达增强多柔比星的抗肿瘤活性
5. SIRT6差异性调控心肌细胞和肿瘤细胞中ATP生成
为了探究SIRT6为何在心肌细胞和肿瘤细胞的命运决定中发挥不同作用,首先,我们发现SIRT6过表达可逆转多柔比星引起的细胞代谢模式异常:多柔比星通过抑制心肌细胞和肿瘤细胞的线粒体呼吸作用,导致细胞的代谢模式从线粒体呼吸向糖酵解转变;而SIRT6过表达则逆转了这一代谢模式,即抑制心肌细胞和肿瘤细胞的糖酵解水平、提高线粒体呼吸活性。
随之而来的一个问题是,既然SIRT6在心肌细胞和肿瘤细胞中具有相同的代谢调控作用,为什么SIRT6过表达在心肌细胞和肿瘤细胞中表现出多柔比星的敏感性差异?事实上,心肌细胞和肿瘤细胞本身的代谢模式差异可能是主要原因。著名的瓦博格效应(Warburg effect)论述了肿瘤细胞即使在氧气充足的情况下也极度依赖糖酵解进行供能,而正常细胞则优先选择产能效率较高的线粒体呼吸途径获得能量。本研究在证实了这一现象的基础上,进一步发现SIRT6过表达抑制糖酵解并促进线粒体呼吸,同时在对心肌细胞和肿瘤细胞内的ATP生成中具有截然不同的作用:在更依赖于线粒体呼吸进行供能的心肌细胞中,SIRT6过表达通过提高线粒体呼吸活性有效逆转了多柔比星对ATP生成的抑制,改善心肌细胞的能量供应,促进其“度过”多柔比星带来的应激状态;而在更依赖糖酵解进行供能的肿瘤细胞中,SIRT6过表达则通过抑制糖酵解显著抑制了ATP生成,与多柔比星产生协同效应,加剧了肿瘤细胞的能量缺乏状态。这一现象较好的解释了为何SIRT6过表达在降低多柔比星对心肌细胞的细胞毒性的同时,增加了对肿瘤细胞的细胞毒性。、

图5 SIRT6过表达通过增强线粒体呼吸和抑制糖酵解差异调节心肌细胞和肿瘤细胞中ATP生成
6. SIRT6通过去乙酰化抑制Sgk1维持线粒体稳态
上述结果证实了SIRT6对糖酵解和线粒体呼吸的调控作用,目前已有研究阐释了SIRT6抑制糖酵解的机制,但SIRT6提高线粒体呼吸活性的机制尚未阐明。因此,本研究通过组学方法,发现并论证了SIRT6可通过直接调控Sgk1启动子区域的组蛋白乙酰化水平抑制Sgk1的表达,并以依赖于Sgk1的方式调控线粒体生物合成和线粒体自噬,从而维持线粒体稳态。该发现解释了SIRT6为什么能逆转多柔比星对线粒体呼吸水平的抑制。

图6 SIRT6通过去乙酰化抑制SGK1调控线粒体稳态
研究结论
综上所述,本研究证实了去乙酰化酶SIRT6可作为一种较为理想的药物靶点,在缓解多柔比星心脏毒性的同时增强其抗肿瘤活性,为蒽环类药物引发心脏毒性的临床干预提供一种新的可行性策略,并为未来的肿瘤治疗提供一种更为安全的新思路。
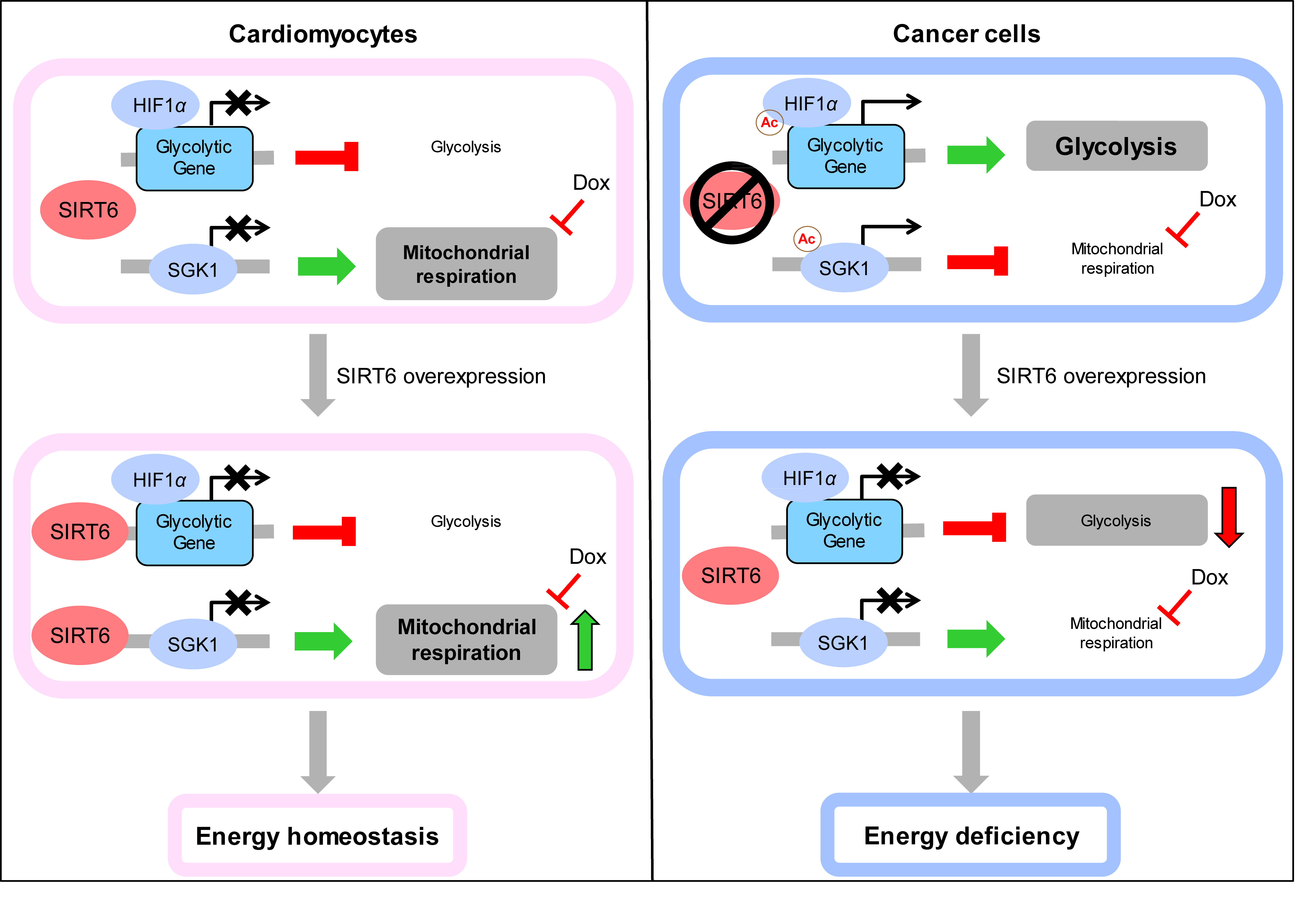
图7 SIRT6诱导的代谢模式对心肌细胞和肿瘤细胞的命运决定具有截然不同的作用
同时,本研究对SIRT6在细胞能量代谢中的作用进行了深入探索,发现SIRT6在抑制糖酵解的同时,通过去乙酰化抑制Sgk1维持线粒体稳态,从而诱导了细胞发生从糖酵解到线粒体呼吸的代谢模式转变,最终在心肌细胞和肿瘤细胞的命运决定中发挥截然不同的作用。以上分子机制的阐明有助于进一步理解SIRT6在细胞能量代谢中的重要作用,并为SIRT6作为一种新型药物靶点应用于肿瘤临床治疗奠定了理论基础。
清华大学药学院王钊教授为本文通讯作者,课题组2022届博士毕业生彭柯峥为本文第一作者,课题组成员高钰琪、曾晨叶、李丽媛、徐康、尹月淼为本课题提供了重要帮助。本课题也得到了清华大学第一附属医院张明奎院长、国家癌症中心/中国医学科学院肿瘤医院马飞教授和刘斌亮博士、完美体育·(中国)官方网站裘莹副教授的大力协助。本研究得到国家自然科学基金、国家重点研发计划、清华精准医学基金、清华春风基金的资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S2211383523001090
