2023年4月6日,尹航研究组在外泌体领域旗舰期刊Journal of Extracellular Vesicles上发表题为“Exosomal lipid PI4P regulates small extracellular vesicle secretion by modulating intraluminal vesicle formation”的文章,报道了一项新的PI4P在调控EV生成的分子机制,并且为EVs调控天然免疫TLR4信号调控提供新证据,为新的EV调控与TLR4天然免疫信号调控提供潜在靶点(图1)。
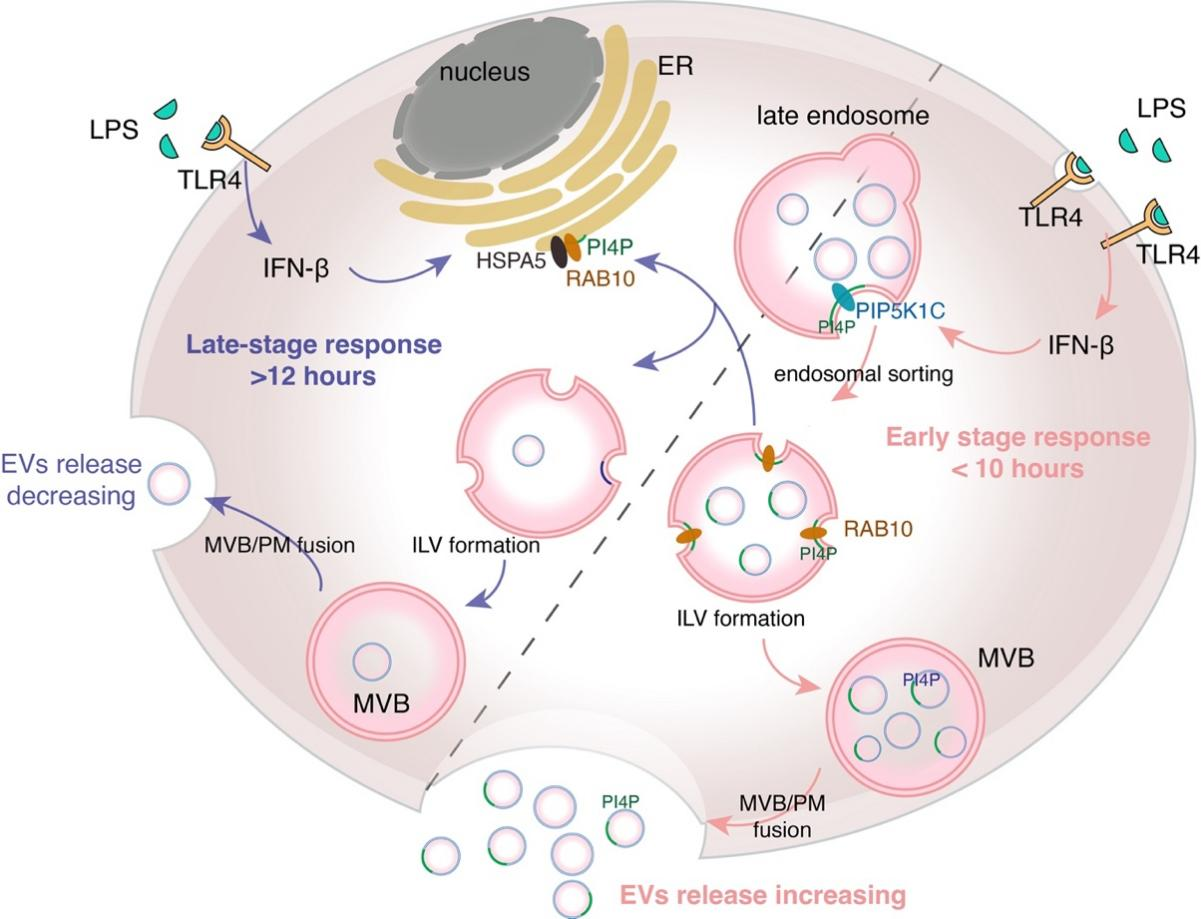
图1 LPS-TLR4 信号通路调节 EVs 释放的分子机制模式图
研究背景
细胞外囊泡(Extracellular Vesicles,EVs)是细胞分泌的磷脂双分子层膜包裹而成的小泡(图1),它不仅是细胞排出垃圾的方式,更在细胞间信号传递中发挥重要功能(1)。Toll样受体(Toll-like receptor, TLR)是天然免疫与适应性免疫之间最重要的桥梁之一,严格的信号传导和时空调控为免疫系统的有序运行提供保障,可有效避免脓毒症等天然免疫疾病的发生(2)。然而,EVs作为重要的细胞间通讯介质,在TLRs信号传递过程中的功能报道尚少,同时TLRs激活是否会调控EVs的生成与释放尚无充分证据。
研究结果
该研究发现,在TLR4激活条件下,巨噬细胞内EVs释放速率随TLR4的配体革兰氏阴性细菌外部细胞壁的一种主要糖脂组分——脂多糖(Lipopolysaccharide,LPS)刺激时间先升高后降低,表现出明显的时间规律。通过与清华大学化学系瑕瑜课题组合作,成功实现对EVs中微量磷脂——磷脂酰肌醇的定量检测,发现介导囊泡生成的磷脂酰肌醇-4-磷酸(Phosphatidylinositol-4-phosphate,PI4P)与EVs的释放速率呈显著正相关关系(图2)。
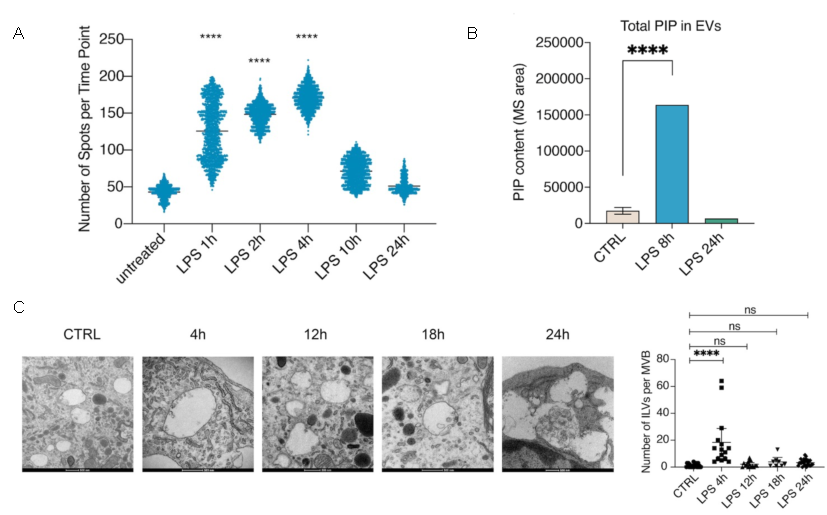
图2 LPS刺激调控EV释放速率变化及EV中PIP含量
探究分子机制发现,LPS刺激短时间内,TLR4激活产生的I型干扰素可调控PI4P激酶表达增加多囊泡体(MVB)上PI4P含量,从而招募下游蛋白促进胞内囊泡(ILV)生成,从而增加EV释放速率;LPS刺激时间增长后,PI4P从MVB减少,从而EVs生成与释放减少。TLR4受体持续性激活所致的过度免疫反应是脓毒血症的主要诱因,EVs所参与的严格时序调控将有效避免信号的持续性激活。
进一步探究EVs释放与LPS刺激信号的关系,发现TLR4天然免疫信号激活后,巨噬细胞内LPS-TLR4下游的TRIF信号通路激活所产生 IFN-β,对PI(4,5)P2激酶PIP5K1C的表达调控实现,通过改变PI4P的定位调控EV的生成(图3)。该结论在巨噬细胞RAW264.7细胞系和C57BL/6J小鼠原代BMDMs生理模型中均表现出一致的调控作用。
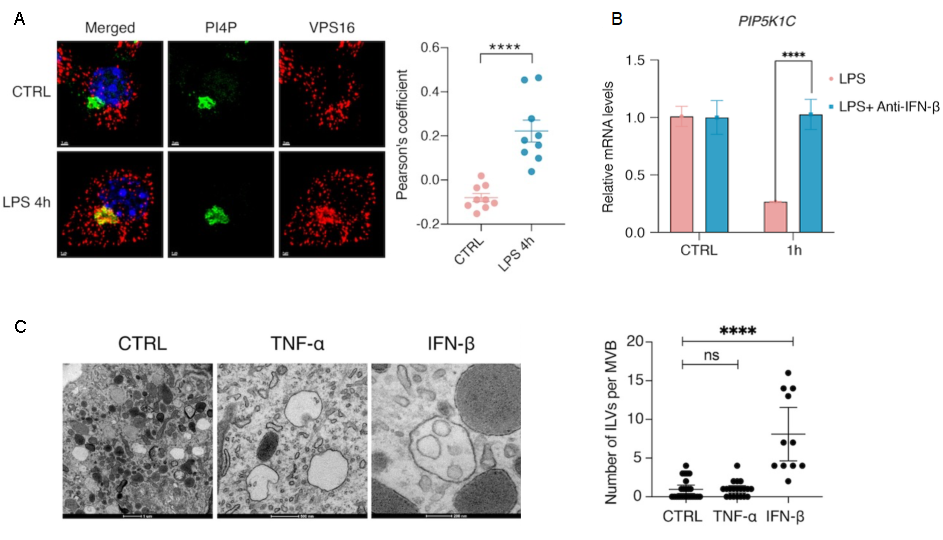
图3 LPS-IFN-β信号通路调控PIP变化及EV前体的生成
研究意义
近年来,由于EV可以实现液体活检以及载药透过血脑屏障等优势,该领域的研究持续升温。天然免疫中EV调控的新机制的发现为疾病的发病机理提供新解释,同时EV生成机制的解析也为其标准化生产提供潜在参考途径。
参考文献
1. G. Raposo et al., B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine 183, 1161-1172 (1996).
2. V. R. Ramirez-Carrozzi et al., A unifying model for the selective regulation of inducible transcription by CpG islands and nucleosome remodeling. Cell 138, 114-128 (2009).
清华大学药学院尹航教授为本文通讯作者,北京大学前沿交叉学科研究院PTN项目2023届博士生靳学为本文第一作者,清华大学瑕瑜教授、张莹博士、2018级博士生夏天以及骆书辰等对为本课题提供重要帮助。感谢国家自然科学基金委、国家科技部重点研发计划、北京市教委提供的经费支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/jev2.12319
